Mit molekularer Diagnostik zur Biomarker-basierten personalisierten Therapie
Voraussetzung für die auf die Heterogenität der Patienten zugeschnittene personalisierte Therapie ist die Diagnostizierung geeigneter Biomarker; am wichtigsten sind dabei Gentests und Genomsequenzierungen. Die größten Erfolge verzeichnet die personalisierte Medizin bisher in der Onkologie. Doch wächst ihre Bedeutung auch für die Behandlung anderer Krankheiten. In Baden-Württemberg liegen die Ausweitung und Weiterentwicklung personalisierter Therapien vor allem bei großen interdisziplinär arbeitenden Einrichtungen wie dem Heidelberger Zentrum für Personalisierte Onkologie und dem Zentrum für Personalisierte Medizin in Tübingen.
Als Ziel der personalisierten Medizin wird oft angegeben, dass sie für jeden Patienten eine auf ihn zugeschnittene Therapie mit den bestgeeigneten Medikamenten anzuwenden sucht. Das – sollte man meinen – ist seit jeher das Ziel jeden guten Arztes. Zu dem durch die personalisierte Medizin bewirkten „Paradigmenwandel“, der jetzt seit gut zehn Jahren vorausgesagt wird, kommt es erst durch den verwendeten methodischen Ansatz. Wie der Tübinger Immunologe Professor Hans-Georg Rammensee es 2016 beschrieben hatte: „Man schaut sich einen Patienten an, analysiert seine Biomarker und sucht sich anschließend aus einem vorhandenen Arsenal von Arzneimitteln ein für den Patienten genau passendes Medikament aus.“
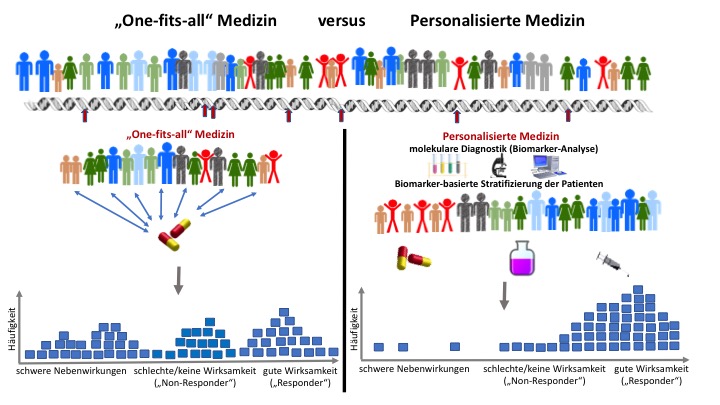 „One-fits-all“-Medizin versus „Personalisierte Medizin“
© EJ, nach einer Vorlage des Helmholtz-Zentrums für Infektionsforschung
„One-fits-all“-Medizin versus „Personalisierte Medizin“
© EJ, nach einer Vorlage des Helmholtz-Zentrums für Infektionsforschung
Personalisierte, individualisierte oder stratifizierte Medizin
Rammensee bezog sich dabei explizit auf die „stratifizierte Medizin“, einen Begriff, der in den letzten Jahren zunehmend anstelle von „personalisierter Medizin“ gebraucht wird. Letzterer steht unter anderem deshalb in der Kritik, weil es doch um molekulare, biologische Eigenschaften des Menschen geht und gerade nicht um die personale Ebene, die sich in Eigenschaften wie Selbsterkenntnis oder Reflexion manifestiert. Synonym mit personalisierter Medizin wird oft der Begriff „individualisierte Medizin“ verwendet, der aber ebenfalls kritisiert wird, weil es in aller Regel nicht um ein unverwechselbares Individuum geht, sondern um die Einordnung des Patienten in eine Subpopulation mit einem bestimmten „Subtyp“ der Erkrankung, die sich durch definierte Eigenschaften („Marker“) von anderen diagnostizierten Subtypen unterscheidet, was man als Stratifizierung (Schichtung) bezeichnet. Wir werden uns im Folgenden aber nicht um die semantischen Unterscheidungen kümmern und weiter von personalisierter Medizin sprechen, da dieser Begriff immer noch der gebräuchlichste ist.
Companion Diagnostics
Genomsequenzierung als eine Basistechnologie der personalisierten Medizin: das Sequenzierzentrum am DKFZ
© DKFZ
Entscheidende Bedeutung hat für diese neue Medizin die Diagnostizierung von Biomarkern, durch die das spezifische Krankheitsbild des Patienten bestimmt und das bestgeeignete Medikament gewählt werden kann. Die Diagnose ist Voraussetzung dafür, dass eine personalisierte Therapie durchgeführt werden kann. Oft geht die Entwicklung des entsprechenden diagnostischen Tests mit der Entwicklung eines hochspezifischen Therapeutikums Hand in Hand oder sogar voraus. Man spricht von „Companion Diagnostics“ (therapiebegleitende Diagnostik), durch die ermittelt wird, ob und wie das Medikament bei dem betroffenen Patienten wirkt.
Beispielsweise ist es für eine Behandlung mit dem therapeutischen Antikörper Trastuzumab gegen metastasierten Brustkrebs oder Magenkrebs zwingend geboten, vorher zu testen, ob die Tumoren eine Überexpression an einem bestimmten Zelloberflächenprotein, dem epidermalen Wachstumsfaktor-Rezeptor HER2, aufweisen, gegen den dieser Antikörper gerichtet ist. In ähnlicher Weise sind für eine personalisierte Therapie von Dickdarm- und Lungenkrebs Tests auf bestimmte Mutationen im KRAS-Gen obligatorisch. Beim metastasierenden Melanom gibt es in vielen Fällen eine spezielle Mutation in einem Onkogen (BRAF-V600), die durch einen entsprechenden Test nachgewiesen werden muss, damit man diesen Tumortyp mit zielgerichteten Medikamenten bekämpfen kann.
Bisher gibt es erst relativ wenige validierte, klinisch geprüfte Begleitdiagnostik-Tests. Doch wird ihre Zahl mit der Zunahme personalisierter Therapien in den nächsten Jahren zweifellos stark ansteigen. Darauf setzt auch das von der Europäischen Union für den Zeitraum von 2017 bis 2020 mit 1,9 Millionen Euro geförderte Interreg-Projekt Codex4SMEs, das unter der Leitung der BioRegio STERN Management GmbH, Stuttgart, die Entwicklung von Companion Diagnostics durch kleine und mittlere Unternehmen in sieben nordwesteuropäischen Staaten vorantreibt.
Genomsequenzierungen von jedem Krebs
Die Zahl der in Deutschland für die personalisierte Medizin zugelassenen Arzneimittel ist mit etwa fünfzig gegenwärtig noch recht überschaubar. Sie wird aber rasch wachsen. Denn unter allen in Entwicklung befindlichen Medikamentenkandidaten beträgt der Anteil für die personalisierte Medizin heute schon 42 Prozent und – wenn man die vorklinischen Phasen der Arzneimittelentwicklung hinzurechnet – sogar 73 Prozent, die in den Pipelines der Pharma-Unternehmen liegen. Der größte Teil dieser Medikamente und Kandidaten entfällt auf den Bereich der Onkologie, in dem die personalisierte Medizin bisher die meisten Erfolge erzielt hat. Bei Krebserkrankungen zeigten sich die Unzulänglichkeiten des „One-fits-all“-Konzeptes (gleiche Therapie für alle Patienten mit – anscheinend – gleichem Krankheitsbild) besonders drastisch in Form von Unverträglichkeiten, schweren Nebenwirkungen und Resistenzen gegenüber den üblicherweise verabreichten Medikamenten.
Als man anfing, die Genome einzelner Tumoren zu sequenzieren, wurde die enorme genetische Heterogenität selbst bei gleichartigen Krebserkrankungen offenbar. In vielen Fällen treten Tausende unterschiedlicher Mutationen auf. Die Analyse der genomischen Veränderungen im Tumor stellt heute eine der entscheidenden Grundlagen der personalisierten Onkologie dar. Am Nationalen Zentrum für Tumorerkrankungen (NCT) in Heidelberg ist es das erklärte – inzwischen fast erreichte – Ziel, allen seinen Tumorpatienten (etwa 3.500 pro Jahr) die „whole genome“-Sequenzierung des Tumorgenoms anzubieten.
Die erforderlichen Sequenzierapparate und die gewaltige Rechenleistung und Datenverarbeitung werden vom Deutschen Krebsforschungszentrum (DKFZ) im Rahmen des Heidelberger Zentrums für Personalisierte Onkologie (HIPO) bereitgestellt. Die anfallenden Datenmengen (ca. 10 Terabytes pro Tag) bewegen sich in der gleichen Größenordnung wie die für das weltweite Blogging-Medium Twitter. Durch diese Analysen können auch die für die Entstehung und das Wachstum von Tumoren ursächlichen molekularen Veränderungen – sogenannte Treibermutationen („driver mutations“) – identifiziert werden, die als Angriffspunkte für neue Therapien oder als prädiktive Biomarker (sogenannte Risikoindikatoren) dienen könnten.
Das DKFZ-HIPO steht auf drei Säulen:
- Genomanalyse-Programm unter Leitung von Professor Peter Lichter
- Programm für Bioinformatik, Systembiologie und Synthetische Biologie, geleitet von Professor Roland Eils
- Präzisionsonkologie-Programm des NCT, geleitet von Professor Christof von Kalle. Durch Einbeziehung von klinischen Entwicklungen neuer personalisierter Arzneimittelkandidaten über das Zentrum hinaus Kooperationen mit der Pharmaindustrie.
HIPO ist europaweit zu einem Vorreiter in der personalisierten Onkologie geworden.
Das Krebsregister und das Zentrum für Personalisierte Medizin (ZPM)
Damit auch Krebspatienten jenseits des Einzugsgebietes der großen Städte und Universitätskliniken von den neuen Behandlungskonzepten profitieren können, muss die entsprechende Information bis zu den niedergelassenen Ärzten im ländlichen Raum durchdringen. Dazu dient das Krebsregister Baden-Württemberg, dem jede neue Krebserkrankung im Land mit detaillierten Angaben über Therapie und Krankheitsverlauf gemeldet werden muss. Der Leiter der Klinischen Landesregisterstelle Dr. Johannes Englert erklärte, dass man für eine optimale Behandlung das Krebsregister auch mit genetischen Informationen und anderen Daten der personalisierten Medizin über den Tumor verknüpfen könnte1; in naher Zukunft ist mit einer solchen Verknüpfung aus datenschutz-, medizinrechtlichen und bioethischen Bedenken, wie sie schon gegen die Einführung der elektronischen Gesundheitskarte vorgebracht worden sind, jedoch nicht zu rechnen.
Neben der Genomik sind für die individuelle Analyse des Krankheitsbildes und die therapiebegleitende Diagnostik auch andere „Omics“-Technologien wie Transkriptomik, Epigenomik, Proteomik und Metabolomik von Bedeutung. Diese Hochdurchsatzverfahren bilden zusammen mit moderner Bildgebung einen Schwerpunkt am Zentrum für Personalisierte Medizin (ZPM) in Tübingen, in dem sich im Rahmen der Exzellenzinitiative der Universität Tübingen 23 Institute und Kliniken zusammengeschlossen haben, um Ansätze der personalisierten Medizin nicht nur im onkologischen Bereich weiterzuentwickeln2. Auch Natur- und Informationswissenschaften sind an diesen Entwicklungen beteiligt. Vorsitzender und Sprecher des ZPM ist Professor Nisar Malek, Ärztlicher Direktor der Medizinischen Klinik I am Universitätsklinikum Tübingen. Die Aufarbeitung der bei den Hochdurchsatztechnologien anfallenden Datenmengen erfolgt durch das Zentrum für Quantitative Biologie (QBiC) der Universität Tübingen unter der Leitung von Professor Oliver Kohlbacher.
Personalisierte Therapie über die Onkologie hinaus
Wirkstoffe im Rahmen der personalisierten Medizin sind nicht auf Krebserkrankungen beschränkt. Als Beispiel sei die Behandlung von HIV-Infizierten mit dem Reverse-Transkriptase-Hemmer Abacavir genannt. Dafür ist ein Gentest auf ein bestimmtes Histokompatibilitätsantigen (HLA-B*5701) vorgeschrieben, da bei Trägern dieses Antigens eine lebensbedrohliche Hypersensibilität gegen das Medikament auftreten kann. Auch für die Therapie von Hepatitis-C-Infektionen „wird die Genetik unter die Lupe genommen, jedoch nicht die des Patienten, sondern des Erregers selbst“, wie Professor Michael Manns, Gründungsdirektor des Zentrums für individualisierte Infektionsmedizin in Hannover, erklärte3: „Je nach Subtyp des Erregers wird die entsprechende wirksame Therapie ausgewählt und der Patient gezielt behandelt.“
Bei komplexen Stoffwechselkrankheiten, die mit erhöhten Cholesterol- und Fettwerten einhergehen, kann durch Gentests eine Stratifizierung der Patientenpopulation vorgenommen werden, um gezielt die wirksamste Behandlungsstrategie auszuwählen. Solche Anwendungen stehen erst am Anfang. Als Biomarker kommen auch Proteine und Stoffwechselprodukte infrage, die auf krankhafte Prozesse im Körper hinweisen und beispielsweise am ZPM in Tübingen durch Proteomik und Metabolomik zuverlässig gemessen werden können. ZPM-Direktor Malek erwähnt ausdrücklich Herzinsuffizienz, bei der durch Modellierungen auf der Basis von „Omics“-Daten in Verbindung mit bildgebenden Verfahren für den jeweiligen Patienten „aus der Fülle theoretisch einsetzbarer Wirkstoffe die gefunden werden könnten, die einzeln oder in Kombination bei genau diesem Patienten am besten helfen.“
Die neuen Therapieansätze sind auch in dem Förderprogramm „Digitalisierung in Medizin und Pflege“ berücksichtigt, das vom Ministerium für Soziales und Integration Baden-Württemberg im Rahmen der Digitalisierungsstrategie des Landes „digital@bw“ aufgelegt worden ist4. Ein von Malek in Tübingen geleitetes Schlüsselprojekt dieser Strategie ist der Aufbau eines „Personalisierte Medizin Portals BW“, das der Weiterentwicklung der personalisierten Medizin und ihrer Verankerung in der Regelversorgung der Patientinnen und Patienten an den Universitätskliniken Tübingen, Heidelberg, Ulm und Freiburg dient. In engem inhaltlichen Zusammenhang damit steht das von Kohlbacher am QBiC in Tübingen geleitete Förderprojekt „bwHealthCloud“. Dieses soll die für die personalisierte Medizin relevanten, bisher nur isoliert vorhandenen klinischen und molekularen Daten über die Behandlung der Patienten an den vier Universitätskliniken mit einer für alle dort behandelnden Ärzte zugänglichen Datenmanagementstruktur zusammenfassen, um sie damit für die Therapieentscheidung und Verlaufskontrolle in ähnlich gelagerten Fällen nutzbar zu machen.