Peptide, vielfältige Moleküle des Lebens
Peptide gibt es in allen Organismen, überall dort, wo es Zellen gibt. Das Spektrum ihrer physiologischen Funktionen ist beträchtlich. Biologisch aktive Peptide treten beispielsweise als Hormone, Neurotransmitter oder Wachstumsfaktoren auf, aber auch als Toxine und Antibiotika. Entsprechend interessant sind sie als Wirkstoffe, sie werden unter anderem zur Behandlung von Autoimmunerkrankungen und Krebs eingesetzt. Trotz einiger Schwierigkeiten genießen Peptide seit einigen Jahren wieder vermehrte Aufmerksamkeit und es wird intensiv nach neuen natürlichen und synthetischen Peptiden gesucht.
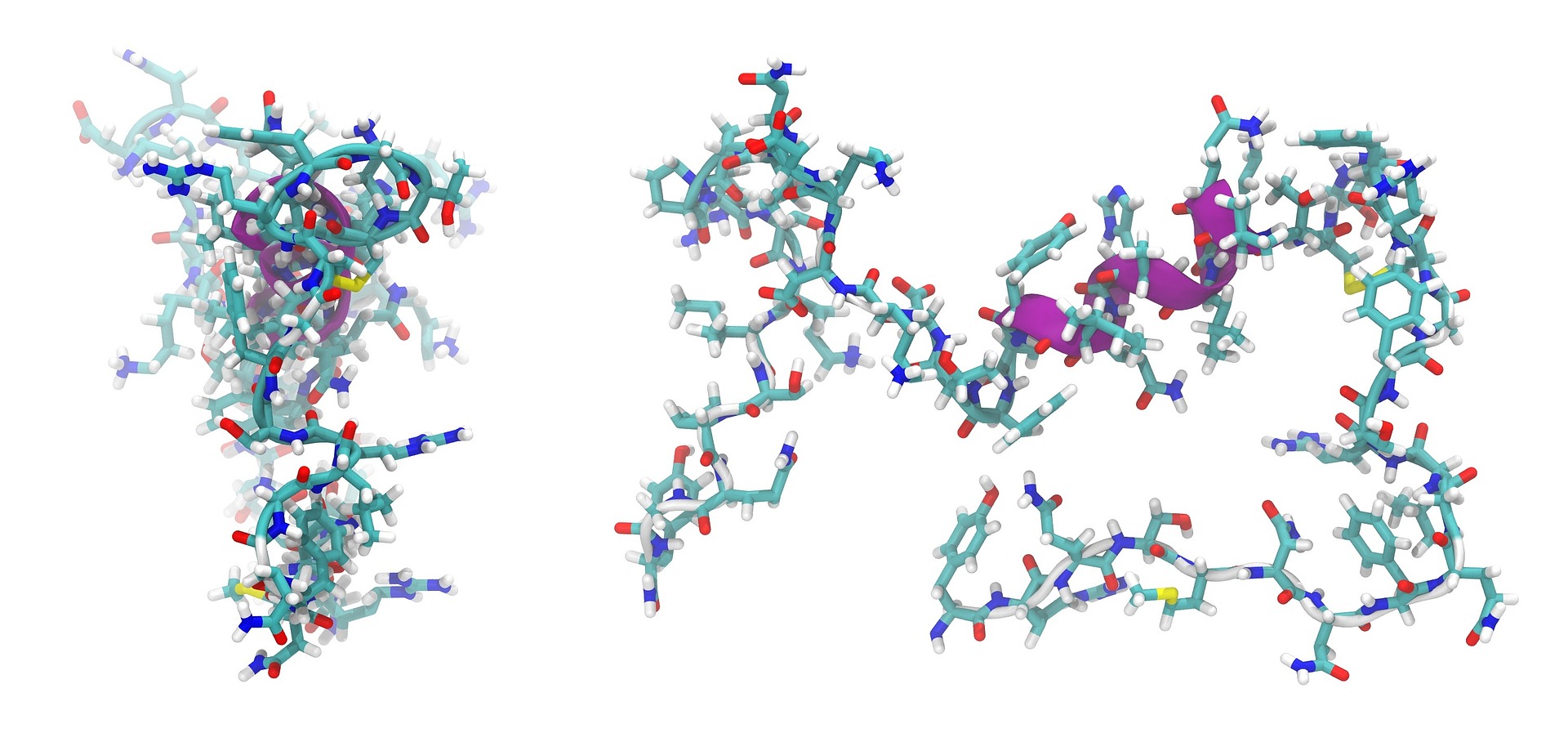 Adrenomedullin ist ein Peptid bestehend aus 52 Aminosäuren. Auf der linken Seite ist das Peptid in seiner nativen Form dargestellt, während auf der rechten Seite die Sekundärstruktur abgebildet ist. © WikimediaImages / pixabay
Adrenomedullin ist ein Peptid bestehend aus 52 Aminosäuren. Auf der linken Seite ist das Peptid in seiner nativen Form dargestellt, während auf der rechten Seite die Sekundärstruktur abgebildet ist. © WikimediaImages / pixabayPeptide sind aus Aminosäuren aufgebaute Moleküle, die jedoch kleiner als Proteine sind. Ab 50 Aminosäuren (in manchen Quellen auch ab 100 Aminosäuren) spricht man von Proteinen. Die Aminosäuren sind durch relativ starre und nicht drehbare Peptidbindungen miteinander verbunden. Diese entstehen, wenn die Carboxylgruppe (-COOH) der einen Aminosäure mit der Aminogruppe (-NH2) der nächsten Aminosäure unter Abspaltung von Wasser verknüpft wird. Neben den Peptidbindungen kommen Disulfidbindungen innerhalb und zwischen Peptidketten, Ester- und Thioesterbindungen vor. Primär seien Peptide Aminosäuren-Ketten, sagt die Ulmer Chemikerin Tanja Weil. Es gibt aber auch verzweigte und ringförmige Peptide.
Peptide werden auf verschiedenen Wegen synthetisiert
Natürliche Peptide können aus proteinogenen und nicht-proteinogenen Aminosäuren bestehen. Um ihre ungeheure Vielfalt zu bändigen, sortiert man sie nach dem Ort ihrer Entstehung. Eukaryonten synthetisieren Peptide über den ribosomalen Weg aus den 20 proteinogenen Aminosäuren. Es entstehen Proteine, die anschließend in Peptide gespalten werden. Oft durchlaufen ribosomale Peptide wie ihre ‚großen Schwestern‘, die Proteine, posttranslationale Modifikationen (u.a. Phosphorylierung, Glykosylierung, Sulfatierung, Hydroxylierung, Disulfidbrücken).
Bakterien und Pilze haben auch die Möglichkeit, kurze Peptide schrittweise unter Mitwirkung verschiedener Enzyme aufzubauen. So können auch nicht-proteinogene L-Aminosäuren und D-Aminosäuren eingebaut werden. Diese Variationen erhöhen zum Beispiel die Stabilität. Diese Peptide sind damit besonders interessant für die pharmazeutische Industrie. Viele Leitstrukturen leiten sich von solchen bakteriellen Peptiden ab.
Zahlreiche Peptide aus Bakterien und Pilzen werden über einen modular organisierten Multi-Enzym-Komplex (NonRibosomal Peptide Synthetase, NRPS) gebildet. Mittlerweile (Stand 7/2013) sind fast 1.200 solcher Peptide (https://www.gesundheitsindustrie-bw.debioinfo.lifl.fr/norine) in 247 Organismen entdeckt.
Hohe Hürde Extraktion und Isolation
Bevor man Peptide chemisch oder rekombinant herstellt, müssen sie extrahiert und isoliert werden. Viel analytisches Geschick gehört dazu, mittels Massenspektrometrie, Flüssigchromatographie (HPLC), Tandemspektrometrie und Kernspinresonanz dem Molekül alle Geheimnisse zu entlocken, ehe man es nachsynthetisiert. Erst der Einsatz vieler Analyse-Techniken ergibt ein Gesamtbild. Damit endet längst nicht das, was die Chemikerin Tanja Weil mit einer Detektivarbeit vergleicht, weil beispielsweise das nachgebaute Peptid seine biologische Aktivität verloren hat. Sind die hohen Anfangshürden genommen, kann man versuchen, das Peptid nachzubauen.
Heute gilt das Interesse den langen Peptiden
Der Begriff „Peptid“ selbst geht auf den deutschen Chemiker und Nobelpreisträger (1902) Emil Fischer zurück, dem 1901 erstmals die Synthese eines Dipeptids gelang. Mit der Etablierung der Festphasen-Synthese erhielt die Peptidforschung (R. M. Merrifield erhielt dafür 1984 den Nobelpreis) einen Schub – der Zugang zu größeren Mengen und reineren Substanzen war geschafft. Später wurde die Festphasen-Synthese automatisiert, Peptid-Synthesizer wurden kommerzialisiert. Hinzu kam die Möglichkeit der rekombinanten Herstellung.
Heute beschäftigt sich die Peptidchemie mit der Herstellung besonders langer Peptide. Denn Peptid-Synthesizer kommen verfahrensbedingt nur bis zu einer Länge von bis zu 30 Aminosäuren in Frage, erklärt Tanja Weil. Die Synthese längerer Peptide gelinge mittlerweile mit Hilfe sogenannter Ligationen, indem man mehrere kurze Peptide zu langen Strukturen verknüpft.
Peptide waren für den Chemiker schon immer attraktiv, weil sie ihm multifunktionale Bausteine an die Hand geben. Ihre zwei reaktiven Gruppen (Carboxy-, Amino-) können zur Polymerisation genutzt werden. Hinzu kommen Seitenketten (mit Ausnahme von Glycin), die wiederum auch funktionelle Gruppen tragen können. Über eine „ausgefeilte Schutzgruppenchemie“ (Tanja Weil) lassen sich Makromoleküle herstellen, die sehr präzise (Sequenz, Länge) definiert sind.
Einen ganz besonderen Weg der Peptidsynthese geht das Unternehmen PEPperPRINT aus Heidelberg, das Peptidarrays herstellt, indem es Peptide mittels Laserdrucker auf Chips druckt.
Peptide als Wirkstoffe
Peptide als Wirkstoffe genießen seit einigen Jahren wieder vermehrte Aufmerksamkeit. Tatsächlich haben Marktbeobachter Hunderte von peptidbasierten Wirkstoffkandidaten in klinischer Entwicklung und noch wesentlich mehr in vorgerückten Phasen der Präklinik in den Pipelines von Pharma und Biotech ausgemacht. Da alle Organismen antimikrobielle Peptide bilden, sucht man intensiv in unterschiedlichen, oft exotischen Organismen - wie Kröten, Spinnen und Schlangen, aber auch Pflanzen und Pilzen - nach neuen Wirkstoffen. Inzwischen hat man auch von Bakterien wie E. coli produzierte Peptide mit antibiotischer Wirkung entdeckt, sogenannte Mikrozine (vgl. Zschüttig et al.).
Das neu gegründete Ulmer Zentrum für Peptidpharmazeutika (UPEP) hingegen stellt die Peptide des Menschen in den Fokus. Die dortigen Forscher suchen im humanen Peptidom nach bioaktiven und immunmodulatorischen Substanzen. Unter anderem wurden von Forschern des UPEP bereits Peptide gefunden, die die Infektiosität von HIV beeinflussen.
Prominentes Beispiel für den Einsatz von Peptiden zu therapeutischen Zwecken ist der gerade in Phase III befindliche peptidbasierte Impfstoff gegen Nierenkrebs des Tübinger Biotech-Unternehmens immatics biotechnologies. Aber auch in der Medizintechnik kommen Peptide zum Einsatz. So werden Implantate entwickelt, die mit antimikrobiellen Peptiden beschichtet sind oder auf denen Peptide aufgebracht sind, die die Biokompatibilität des Implantates erhöhen.
Auch außerhalb der Medizin gibt es interessante Verwendungsmöglichkeiten für Peptide. Am Institut für Technische Biochemie an der Universität Stuttgart wird an Verbundmaterialien aus Peptiden und anorganischen Komponenten geforscht. Solche Schichtenaufbauten sind zum Beispiel interessant für die Konstruktion elektronischer Bauelemente.
Literatur:
Königshoff M, Brandenburger T. Kurzlehrbuch Biochemie. Stuttgart/New York: Thieme 2012 (3., überarbeitete Aufl.)
Caboche S, Leclère V, Pupin M, Kucherov G, Jacques P: Diversity of monomers in nonribosomal peptides: towards the prediction of origin and biological activity. J Bacteriol 2010;192(19), 5143-50, doi: 10.1128/JB.00315-10
Venoms for Health, EU-Projekt des 7. FRP (2011-2015): https://www.gesundheitsindustrie-bw.dewww.venomics.eu
Zschüttig A, Zimmermann K., Blom J, Goesmann A, Pöhlmann Ch, Gunzer F: Identification and Characterization of Microcin S, a New Antibacterial Peptide Produced by Probiotic Escherichia coli G3/10, March 30, 2012, DOI: 10.1371/journal.pone.003335 (PLoS ONE), https://www.gesundheitsindustrie-bw.dewww.plosone.org/article/info%3Adoi%2F10.1371%2Fjournal.pone.0033351
Emil Fischer - Biographical: https://www.gesundheitsindustrie-bw.dewww.nobelprize.org/nobel_prizes/chemistry/laureates/1902/fischer-bio.html
The Antimicrobial Peptide Database: https://www.gesundheitsindustrie-bw.deaps.unmc.edu/AP/main.php
Probleme beim Drug-Design
Obwohl Peptide bereits seit vielen Jahren als Wirkstoffe dienen, stellt die Verabreichung noch immer ein Problem dar. Peptide werden im Magen-Darm-Trakt schnell abgebaut, so dass sie subkutan oder intravenös verabreicht werden müssen. Weiterhin werden sie schnell über Nieren und Leber ausgeschieden. An der Entwicklung neuer Verpackungsformen, aber auch an modifizierten Peptidstrukturen, die die Moleküle zum Beispiel stabiler machen, wird deshalb intensiv geforscht. Da Peptide einerseits synthetisch relativ gut hergestellt werden können, andererseits vielfältige Prozesse im Körper entscheidend beeinflussen, sind sie für die Pharmaindustrie aber trotz der genannten Probleme sehr interessant.
KS