Preisbildungsprozess bei neuen Arzneimitteln
AMNOG: Das Arzneimittelmarktneuordnungsgesetz – Ein Überblick über Ziele, Verfahren und Herausforderungen
Das Arzneimittelmarktneuordnungsgesetz (AMNOG) ist maßgeblich für den Preis, zu dem neue Medikamente auf den deutschen Markt kommen. Das Verfahren soll vor allem dafür sorgen, dass der Zusatznutzen neuer Wirkstoffe für die Patientinnen und Patienten im Fokus steht. Ein System mit Vor- und Nachteilen.
 Prof. Dr. Jürgen Wasem, Gesundheitsökonom an der Universität Duisburg-Essen und ehemaliger Vorsitzender der AMNOG-Schiedsstelle, Copyright: Jürgen Wasem (a); Dr. Sven Prietzel, Geschäftsführer Gesundheitspolitik beim Verband Forschender Arzneimittelhersteller (vfa), Copyright: vfa (b); Dr. Christian Korbanka, Leiter Stab Politik bei der IKK classic, Copyright: IKK classic (c)
Prof. Dr. Jürgen Wasem, Gesundheitsökonom an der Universität Duisburg-Essen und ehemaliger Vorsitzender der AMNOG-Schiedsstelle, Copyright: Jürgen Wasem (a); Dr. Sven Prietzel, Geschäftsführer Gesundheitspolitik beim Verband Forschender Arzneimittelhersteller (vfa), Copyright: vfa (b); Dr. Christian Korbanka, Leiter Stab Politik bei der IKK classic, Copyright: IKK classic (c)Das AMNOG legt seit 2011 in Deutschland das Verfahren fest, mit dem die Preise von Arzneimitteln mit neuen Wirkstoffen reguliert werden. Was auf den ersten Blick abstrakt wirkt, hat in der Praxis weitreichende Folgen: Es entscheidet darüber, wie leicht Patientinnen und Patienten Zugang zu neuen, teils lebensrettenden Medikamenten erhalten. Gleichzeitig müssen deren Entwicklung und Vertrieb für Pharmaunternehmen wirtschaftlich bleiben – und für Krankenkassen finanzierbar sein. Genau dieses Spannungsfeld verschiedener Interessen regelt das AMNOG.
Prof. Dr. Jürgen Wasem, Gesundheitsökonom an der Universität Duisburg-Essen und ehemaliger Vorsitzender der AMNOG-Schiedsstelle, Dr. Sven Prietzel, Geschäftsführer Gesundheitspolitik beim Verband Forschender Arzneimittelhersteller (vfa), und Dr. Christian Korbanka, Leiter Stab Politik bei der IKK classic, erklären, wie das AMNOG funktioniert, welche Vor- und Nachteile es für die Beteiligten hat, und wie aktuelle Entwicklungen das Verfahren beeinflussen könnten.
Was genau ist das AMNOG?
Das Arzneimittelmarktneuordnungsgesetz, kurz AMNOG, wurde 2010 vom Deutschen Bundestag verabschiedet und trat am 01.01.2011 in Kraft. Es regelt im Wesentlichen, zu welchem Preis neue Medikamente von den Krankenkassen erstattet werden. Die Grundidee ist einfach: Neue Arzneimittel, die einen Mehrwert für Patientinnen und Patienten bieten, dürfen teurer sein als die Standardtherapie. Liefert ein neues Medikament hingegen keinen erkennbaren Zusatznutzen, darf es nicht mehr kosten als die bestehende Behandlung.
Damit sollten insbesondere stark steigende Medikamentenpreise eingedämmt werden. Denn, so formulierte es das Gesundheitsministerium in einer Broschüre zum Start des AMNOG: „Das Problem der stark ansteigenden Arzneimittelausgaben liegt […] nicht im Bereich der etablierten Wirkstoffe und Medikamente.“ Deren Kosten seien sogar rückläufig (2009, vor Einführung des AMNOG, minus 2 Prozent). Vielmehr seien es vor allem neue Arzneimittel, die die Ausgaben nach oben trieben, obwohl sie nicht immer einen tatsächlichen Mehrwert für die Patientinnen und Patienten böten. Vor diesem Hintergrund entstand das AMNOG: Der Preis neuer Medikamente sollte künftig vom nachgewiesenen Zusatznutzen abhängen. Arzneimittel ohne therapeutischen Mehrwert sollten nicht unnötig hohe Kosten für die Krankenkassen verursachen.
Das Preisfindungsverfahren erfolgt dabei in drei Schritten: Zunächst bewertet der Gemeinsame Bundesausschuss (G-BA) den Zusatznutzen eines neuen Medikaments. Es wird mit der aktuellen „Standardtherapie“, einer sogenannten zweckmäßigen Vergleichstherapie (zVT), verglichen und analysiert, ob und in welchem Maß es bessere Ergebnisse liefert. Nach sechs Monaten Prüfzeit veröffentlicht der G-BA seine Bewertung. Auf dieser Grundlage verhandeln Pharmaunternehmen und Krankenkassen den Erstattungspreis.
Laut G-BA spart das AMNOG-Verfahren mittlerweile jährlich rund 3 - 4 Mrd. Euro ein. Es beeinflusst dabei nicht, ob ein Medikament verschrieben werden darf. Das hängt allein von der Zulassung ab. Beim AMNOG geht es lediglich um die Erstattung durch die Krankenkassen. Selbst wenn ein Medikament vom deutschen Markt verschwindet, weil sich Hersteller und Kassen nicht einigen, haben Patientinnen und Patienten unter bestimmten Voraussetzungen weiterhin einen Rechtsanspruch darauf, es gegebenenfalls aus dem Ausland zu beziehen. Dass ein Medikament mangels Einigung vom deutschen Markt verschwindet, kommt allerdings nur sehr selten vor.
Komplexer Interessensausgleich - warum sind neue Medikamente oft sehr teuer?
Der Kern des AMNOG ist ein hochkomplexer Interessensausgleich, bei dem folgende Bereiche berücksichtigt werden müssen:
- Der Zugang der Patientinnen und Patienten zu den besten Arzneimitteln.
- Die Bezahlbarkeit von Therapien für die Gesetzlichen Krankenversicherer.
- Die Innovationskraft von Pharmaunternehmen.
Dass Medikamentenpreise oft hoch sind, hat gute Gründe: Die Entwicklung neuer Wirkstoffe ist aufwendig und langwierig. Bis ein Medikament auf den Markt kommt, vergehen Jahre, in denen ein neuer Wirkstoff nicht nur gefunden, sondern auch in mehreren Stufen auf Sicherheit getestet werden muss – und zwar vom Labor bis zu den Patientinnen und Patienten. Hinzu kommt das finanzielle Risiko: Viele Projekte scheitern, sodass Unternehmen nicht selten auf hohen Kosten sitzenbleiben. Das Deutsche Krebsforschungszentrum (DKFZ) stellte in einer Untersuchung der verfügbaren Daten im Jahr 2021 fest, dass die tatsächlichen Entwicklungskosten pro Medikament stark variieren und zwischen 137 Mio. und bis zu 3,86 Mrd. Euro geschätzt werden. Besonders teuer sind dabei laut DKFZ Krebsmedikamente – und das schlägt sich auch später im Preis nieder. „Da haben die Hersteller oft eine Preisvorstellung von 50.000 Euro für die Therapie. Gezahlt werden dann meist eher 2.000 - 3.000 Euro“, erklärt Gesundheitsökonom Wasem.
„Das AMNOG begründet insgesamt ein ausgewogenes System“, sagt Prietzel. „Aber wir müssen in Deutschland schon zur Kenntnis nehmen, dass wir nicht mehr auf allen Gebieten das Nonplusultra sind. So ist die Zahl innovativer Medikamente, die zugelassen werden und letztlich für die Versorgung zur Verfügung stehen, in den USA höher als hierzulande. Und das hat etwas mit innovationsförderlichen Rahmenbedingungen zu tun.“ So kritisierten Pharmaunternehmen hierzulande immer öfter die Ergebnisse der Nutzenbewertung.
Die Krankenkassen hingegen monieren die stetig steigenden Arzneimittelkosten. Besonders hoch seien die Therapiekosten bei Medikamenten für seltene Erkrankungen (Orphan Drugs), obwohl deren Entwicklung laut DKFZ oft vergleichsweise günstig ist. Allerdings sei es schwer, die Entwicklungskosten zu amortisieren, wenn ein Wirkstoff nur selten verkauft wird. „Wir haben tatsächlich eine größere Zahl von sehr hochpreisigen Therapien, bei denen die Jahrestherapiekosten zwischen 150.000 und 1 Mio. Euro liegen, manchmal in sehr kleinen Kohorten mit 3 Patienten, 30 Patienten, 100 Patienten in Deutschland“, erläutert Wasem.
„Aus Perspektive der gesetzlichen Krankenkassen stellt die zunehmende Anzahl hochpreisiger Arzneimittel, insbesondere in der Onkologie und bei seltenen Erkrankungen, eine echte finanzielle Herausforderung dar“, sagt Korbanka. Im Hinblick auf das AMNOG kritisiert er das Privileg des „fiktiven“ Zusatznutzens für Orphan Drugs. Solange sie nicht mehr als 30 Mio. Euro Umsatz pro Jahr erzielen, müssen Hersteller dabei keinen Zusatznutzen gegenüber Vergleichstherapien belegen. „Problematisch ist in diesem Zusammenhang die Möglichkeit für die Pharmaunternehmen, den Preis des Arzneimittels willkürlich zu bestimmen. Auch basieren die Verhandlungen zum Erstattungspreis auf dem anfänglichen „Wunschpreis“ des pharmazeutischen Unternehmens“, betont Korbanka.
Gesetzliche Grundlage und Ablauf des AMNOG-Verfahrens
Für den Ausgleich dieser widerstreitenden Interessen soll das AMNOG sorgen. Es ist jedoch nicht die eigentliche gesetzliche Grundlage für die Nutzenbewertung, sondern führte entsprechende Änderungen in anderen Gesetzestexten ein. Das eigentliche Verfahren, insbesondere die Nutzenbewertung und die Preisverhandlung, ist weitestgehend in § 35a des Fünften Sozialgesetzbuchs (SGB V) geregelt.
Wesentlich sind dabei die verschiedenen Schritte zur Festlegung des Erstattungsbetrags: Zunächst erfolgt die Nutzenbewertung, anschließend verhandeln Pharmaunternehmen und der GKV-Spitzenverband über den Preis. Kommt keine Einigung zustande, entscheidet eine Schiedsstelle. Der gesamte Prozess von der Markteinführung eines neuen Arzneimittels bis zur endgültigen Preisfestlegung dauert in der Regel 12 - 15 Monate.
Im Einzelnen verlaufen die verschiedenen Phasen folgendermaßen:
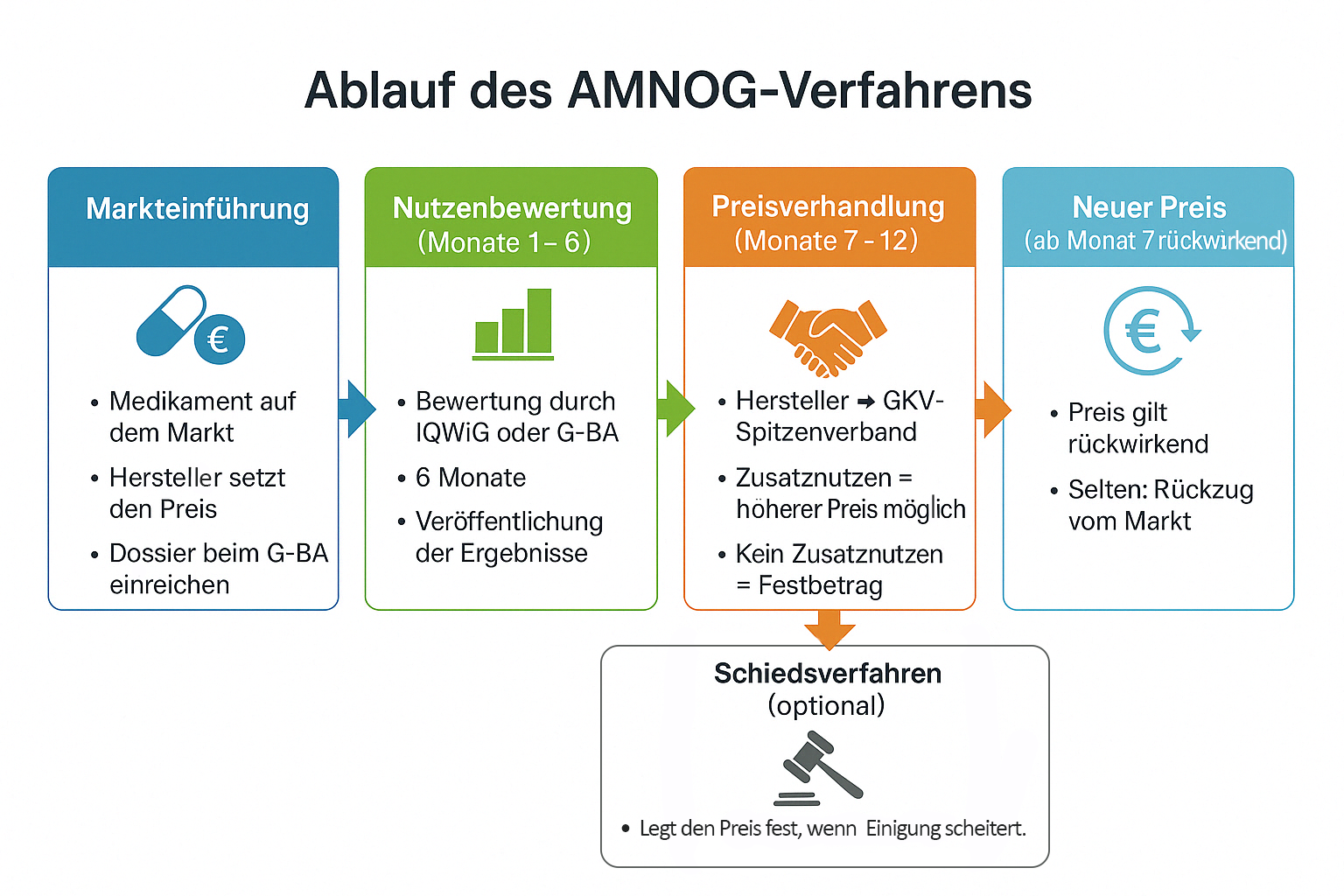 Ablauf des AMNOG-Verfahrens. Quelle: Anja Segschneider, erstellt mit DALL-E.
Ablauf des AMNOG-Verfahrens. Quelle: Anja Segschneider, erstellt mit DALL-E.
1. Markteinführung und erste Preisfestsetzung
- Der Hersteller bringt das Medikament auf den Markt und setzt den Preis zunächst frei fest.
- Gleichzeitig muss er ein Dossier zur Nutzenbewertung beim Gemeinsamen Bundesausschuss (G-BA) einreichen.
- In diesem Dossier legt der Hersteller dar, welchen Zusatznutzen sein Medikament im Vergleich zur zweckmäßigen Vergleichstherapie (zVT) bietet.
Die Vergleichstherapie wird vom G-BA festgelegt und basiert auf etablierten Standardtherapien im jeweiligen Anwendungsgebiet.
2. Nutzenbewertung (Monate 1–6)
- Der G-BA beauftragt in der Regel das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) oder die G-BA-Geschäftsstelle mit der Nutzenbewertung.
Die Bewertung dauert sechs Monate, danach wird das Ergebnis veröffentlicht.
3. Preisverhandlungen (Monate 7–12)
- Der Hersteller tritt in direkte Verhandlungen mit dem GKV-Spitzenverband ein, der die Interessen der gesetzlichen Krankenkassen vertritt.
- Grundlage der Verhandlungen ist die Nutzenbewertung:
- Ein höherer Zusatznutzen bedeutet, ein höherer Preis als die Vergleichstherapie ist möglich.
- Wenn es keinen Zusatznutzen gibt, wird das Medikament dem Festbetragssystem zugeordnet. Der Preis darf dann nicht höher sein als die Vergleichstherapie.
Falls keine Einigung erzielt wird, entscheidet die Schiedsstelle.
4. Schiedsverfahren (optional, Monate 12–15)
Der festgelegte Preis ist bindend, jedoch können sich die betroffenen Parteien rechtlich dagegen wehren.
5. Inkrafttreten des neuen Preises (rückwirkend auf Monat 7)
- Der vereinbarte oder festgelegte Preis gilt rückwirkend ab dem 7. Monat nach Markteinführung.
Hersteller können sich entscheiden, das Medikament vom deutschen Markt zu nehmen, falls der festgelegte Preis wirtschaftlich nicht tragbar ist. In der Praxis passiert das aber sehr selten.
Weitere regulatorische Vorgaben des AMNOG
Neben der Nutzenbewertung brachte das AMNOG weitreichende Reformen. Das Festbetragssystem und die Rabattverträge wurden überarbeitet, um fairen Wettbewerb sicherzustellen. Gleichzeitig wurden bürokratische Hürden abgebaut, unter anderem durch eine Vereinfachung der Wirtschaftlichkeitsprüfung für Ärztinnen und Ärzte. Zudem gab es Maßnahmen zur höheren Transparenz, darunter die Veröffentlichung von klinischen Studiendaten. Allerdings wurden diese Vorgaben durch spätere Gesetzesänderungen modifiziert. Erstattungsbeträge für neue Arzneimittel gelten nun bereits ab dem 7. Monat nach Markteintritt (statt wie ursprünglich ab dem 13. Monat), und für Orphan Drugs wurde die Umsatzschwelle gesenkt. Mit der europäischen HTA-Verordnung, die im Januar 2025 in Kraft trat, wird zudem eine engere Verzahnung der deutschen Nutzenbewertung mit der EU-weiten Bewertung neuer Arzneimittel gewährleistet. Künftig sollen zudem vertrauliche Erstattungsbeträge für Unternehmen möglich sein, die Forschung in Deutschland betreiben.
Zeitschiene: Weiterentwicklung des AMNOG
Das AMNOG hat seit 2011 einige Anpassungen erfahren:
2011 | GKV-Versorgungsstrukturgesetz
betroffen: Erstattungsbetragsverhandlungen.
2012 | 2. Gesetz zur Änderung arzneimittelrechtlicher und anderer Vorschriften
betroffen: Erstattungsbeträge; Dossier-Einreichung; Beratung des pharmazeutischen Unternehmens durch den G-BA.
2013 | 3. Gesetz zur Änderung arzneimittelrechtlicher und anderer Vorschriften
betroffen: zVT-Bestimmung; Bestandsmarktaufruf; Dossier-Einreichung; Erstattungsbetrag; Schiedsstelle.
2014 | 14. SGB V-Änderungsgesetz
betroffen: Aufhebung der Nutzenbewertung des Bestandsmarkts; Erstattungsbetragsverhandlungen.
2015 | Gesetz für sichere digitale Kommunikation und Anwendungen im Gesundheitswesen
betroffen: Schiedsstelle.
2017 | GKV-Arzneimittelversorgungsstärkungsgesetz
betroffen: Privilegien für Kinderarzneimittel und Reserveantibiotika bzgl. des Nachweises eines Zusatznutzens; Nutzenbewertung des Bestandsmarkts eingeschränkt wieder möglich; Integration der Nutzenbewertung in das Arztinformationssystem; Dossier-Einreichung; Erstattungsbetrag; Antragsverfahren; Soll-Regelung.
2019 | Terminservice- und Versorgungsgesetz & Gesetz für mehr Sicherheit in der Arzneimittelversorgung
betroffen: Schiedsstelle; anwendungsbegleitende Datenerhebung bei Orphan Drugs; Qualitätsanforderungen für ATMP (Advanced Therapy Medicinal Products); Berechnung der Umsatzschwelle bei Orphan Drugs; Bestimmung der zVT; Transparenz der Erstattungsbeträge.
2020 | GKV-Fairer-Kassenwettbewerb-Gesetz
betroffen: Möglichkeit zur Freistellung von der Nutzenbewertung für Reserveantibiotika; Dossier-Einreichung bei ATMP; anwendungsbegleitende Datenerhebung; Risikopool zur Finanzierbarkeit hochpreisiger Arzneimittel; Erstattungsbetrag.
2022 | GKV-Finanzstabilisierungsgesetz
betroffen: Senkung des Erstattungsbetrags bei neuen Arzneimitteln mit geringem oder nicht quantifizierbarem Zusatznutzen (Orientierung am Patentschutz der zVT); Erstattungsbeträge gelten rückwirkend ab dem 7. Monat nach Marktzulassung (AMNOG Version 2010: ab 13. Monat); Verlängerung des Preismoratoriums (bis Ende 2026); Reduktion der Umsatzschwelle für Orphan Drugs (von 50 auf 30 Mio. Euro).
2024 | Medizinforschungsgesetz
betroffen: Lockerung der Leitplanken (GKV-Finanzstabilisierungsgesetz) für Arzneimittel mit geringem bzw. nicht quantifizierbarem Zusatznutzen, bedingt durch die Durchführung der Klinischen Prüfungen mit fünf Prozent Probanden oder Probandinnen aus Deutschland; Einführung von vertraulichen Erstattungsbeträgen für Unternehmen, die Arzneimittelforschung in Deutschland nachweisen können (Erprobungszeit bis 30.06.2028).
2025 | HTA-Verordnung
betroffen: Einführung der EU-weiten Klinischen Bewertung (Joint Clinical Assessment, JCA) für neue Arzneimittel; verpflichtende Nutzung der JCA-Ergebnisse durch die Mitgliedstaaten im nationalen Nutzenbewertungsverfahren; nationale Erstattungsentscheidungen und Preisverhandlungen bleiben unberührt; schrittweise Ausweitung auf weitere Arzneimittelgruppen bis 2030; neue methodische Anforderungen und frühere Fristen für Pharmaunternehmen.
Kritik am AMNOG-Verfahren und Ausblick
Auch wenn alle Seiten das AMNOG-Verfahren grundsätzlich für eine ausgewogene Lösung halten, gibt es immer wieder Kritik daran. Gesundheitsökonom Wasem sieht eines der größten Probleme darin, wie der Zusatznutzen festgelegt wird: Gerade bei chronischen Erkrankungen oder präventiven Medikamenten sei der Vorteil für die Patientinnen und Patienten schwer messbar. „Wir haben eine deutlich höhere Rate positiver Nutzenbewertungen in der Onkologie bei Krebserkrankungen, was einfach daran liegt, dass man beim Krebs häufig doch sehr früh Unterschiede im Überleben sieht. Und Überleben ist klar ein patientenrelevanter Endpunkt. Das ist bei Asthma oder bei Diabetes deutlich schwieriger festzumachen.“
Die Maßstäbe für die Bewertung kritisiert der vfa ebenfalls seit langem: „Auch die Versorgungsperspektive sollte eine stärkere Rolle spielen, beispielsweise wenn ein Arzneimittel aufgrund starrer Vorgaben formal keinen Zusatznutzen zeigen kann, jedoch klar einen Versorgungsbedarf abdeckt oder das Gesundheitssystem im stationären Bereich entlastet. Solche Aspekte bleiben bislang unberücksichtigt“, erläutert Prietzel. Der Pharmaverband hat mehrfach Reformvorschläge veröffentlicht, etwa 2023 mit „AMNOG 2025“ und Ende 2024 mit „Zukunft AMNOG“. Im Wesentlichen wünschen sich die Pharmaunternehmen, dass die frühe Nutzenbewertung stärker den Versorgungsbeitrag eines Arzneimittels berücksichtigt und eine bessere Dateninfrastruktur realitätsnahe Entscheidungen ermöglicht. Zudem fordert der vfa flexiblere Erstattungsmodelle wie „Pay-for-Performance“ und Sonderregelungen für innovative Therapien wie Gentherapien. Solche neuartigen Therapien könnten die Behandlung bisher kaum therapierbarer Krankheiten revolutionieren. Doch Gesundheitsökonom Wasem warnt bei allem Nutzen auch vor erheblichen finanziellen Herausforderungen: Zwar könnten innovative Behandlungen wie Gentherapien langfristig Kosten sparen, indem sie chronische Krankheiten heilen, doch kurzfristig sei das System damit überfordert. „Wir können nicht zusätzlich zu den 60 Mrd. Euro, die wir jährlich bereits jetzt für Arzneien ausgeben, noch zusätzliche 10 Mrd. nur für eine einzige Gentherapie in Parkinson bezahlen. Und das ist nur eines von vielen Beispielen. Es gibt hunderte von Gentherapien, die in Studien erprobt werden.“
Die Krankenkassen fürchten zudem, dass die neuen vertraulichen Erstattungsbeträge des Medizinforschungsgesetzes die Kosten weiter in die Höhe treiben. „Dies könnte ein intransparentes System schaffen, das einen öffentlichen Diskurs zur Preisgestaltung verhindert und die Möglichkeiten der Leistungserbringer einschränkt, wirtschaftlich zu agieren“, meint Korbanka. Auch der GKV-Spitzenverband hat bereits Wünsche für eine Reform geäußert. Kritisiert wird insbesondere die oft unzureichende Evidenz bei neu zugelassenen Arzneimitteln. Der GKV-Spitzenverband fordert daher eine stärkere Kopplung der Erstattung an nachgewiesene Behandlungserfolge, ein Interimspreismodell bis zur endgültigen Nutzenbewertung, eine systematische Aktualisierung der Nutzenbewertungen sowie eine Rückwirkung der Erstattungsbeträge ab Marktzugang. Zudem solle die Preisbildung stärker an realen Forschungs- und Entwicklungskosten ausgerichtet werden.
Wasem plädiert langfristig für eine stärkere Orientierung an der gesundheitsökonomischen Effektivität: „Ich halte eine Kosten-und-Nutzen-Bewertung neuer Therapien für eine vernünftige Alternative. Das wäre für alle Seiten am fairsten.“
Die verschiedenen Interessen unter einen Hut zu bringen, wird schwierig bleiben. Doch bei aller Kritik gibt es auch Gemeinsamkeiten. So betrachten alle Parteien die neue europäische HTA-Verordnung grundsätzlich als sinnvolle Maßnahme, da sie die Nutzenbewertung von Arzneimitteln in Europa vereinheitlicht. Für das deutsche AMNOG-Verfahren wird sie wenig ändern. Und trotz aller Debatten herrscht ebenfalls Einigkeit darüber, dass Deutschland nach wie vor über ein funktionierendes Bewertungs- und Erstattungssystem verfügt – und noch immer den effektivsten Zugang zu neuen Medikamenten in Europa bietet.