Virale Zoonosen
Hemmstoffentwicklung gegen virale Zoonosen
Neu auftretende virale Infektionen wie Corona oder Zika stellen eine zunehmende Gefahr für den Menschen dar. Am Institut für Pharmazie und Molekulare Biotechnologie (IPMB) der Universität Heidelberg entwickelt die Arbeitsgruppe von Prof. Dr. Christian Klein Hemmstoffe gegen bereits bekannte Erreger in der Hoffnung, dass diese auch gegen neue Varianten eingesetzt werden können.
Der enge Kontakt zwischen Menschen und Tieren begünstigt die gegenseitige Ansteckung mit Krankheitserregern. Dies kann fatale Folgen haben, wie das Beispiel von COVID-19 zeigt. Zoonosen – Erkrankungen, die zwischen Tier und Mensch übertragbar sind – werden von Viren, Bakterien, Parasiten, Prionen oder Pilzen ausgelöst. Die Übertragung findet dabei entweder auf direktem Weg durch Kontakt mit dem infizierten Tier bzw. kontaminierten Lebensmitteln (zum Beispiel bei Salmonellen-Infektionen) oder über einen Zwischenwirt wie Zecken (Borreliose) oder Mücken (Malaria) statt. Aufgrund der hohen Mobilität des Menschen und seines Eindringens in bisher unbewohnte Lebensräume traten in den letzten Jahren vermehrt neue, gefährliche Zoonosen auf, wie beispielsweise Ebola- oder Zika-Erkrankungen.
Auf der Suche nach Wirkstoffen gegen virale Zoonosen
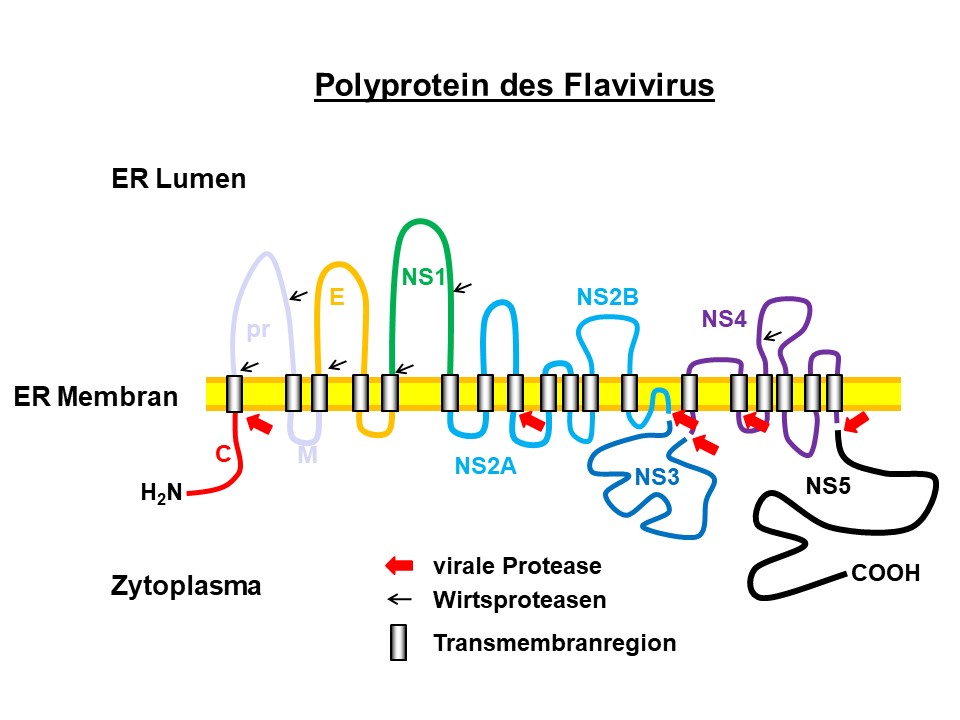 Basierend auf der (+)-RNA-Vorlage wird das virale Protein am rauen Endoplamatischen Retikulum (ER) synthetisiert und in die ER-Membran eingebaut. Virale Proteasen, aber auch Wirtsproteasen, setzen durch Spaltung der Proteinkette die verschiedenen Virusproteine frei. © C. Klein
Basierend auf der (+)-RNA-Vorlage wird das virale Protein am rauen Endoplamatischen Retikulum (ER) synthetisiert und in die ER-Membran eingebaut. Virale Proteasen, aber auch Wirtsproteasen, setzen durch Spaltung der Proteinkette die verschiedenen Virusproteine frei. © C. KleinDie Arbeitsgruppe Pharmazeutische und Medizinische Chemie von Prof. Dr. Christian Klein am Institut für Pharmazie und Molekulare Biotechnologie (IPMB) der Universität Heidelberg erforscht seit mehr als zwölf Jahren Wirkstoffe gegen virale Zoonosen. Der Fokus der Forschenden liegt hierbei auf von der Gattung Flavivirus verursachten Erkrankungen. Zu diesen zählen die in Deutschland durch Zecken verbreitete Frühsommer-Meningoenzephalitis (FSME), aber auch die eher in den Tropen auftretenden Zika-, Dengue- und West-Nil-Fieber. Letztere werden durch Mücken übertragen und zeigen oft lebensbedrohliche Verläufe.
Die genetische Information der im Durchmesser 40 - 60 nm großen, infektiösen Partikel der Flaviviren (Virionen) besteht aus einem (+)-RNA-Einzelstrang, der in einem Proteinkapsid verpackt und von einer Membranhülle umgeben ist. Neben Endothelzellen an der Einstichstelle befallen die Virionen unter anderem auch Immunzellen wie Makrophagen, Monozyten und dendritische Zellen, über die sie im ganzen Körper verteilt werden. In den Wirtszellen dient die Virus-RNA als direkte Vorlage für die Synthese eines langen Polyproteins, also einer Kette aus miteinander verknüpften, unterschiedlichen Virusproteinen. Durch Spaltung der Kette mittels Proteasen werden die einzelnen Proteine freigesetzt und können dann ihre Funktion bei der Vermehrung des Erregers erfüllen. Dieser essenzielle Prozess wird vor allem durch viruseigene Enzyme ausgeführt, die ebenfalls Bestandteil des Polyproteins sind.
Protease-Inhibitoren verhindern Vermehrung des Erregers
Da ohne Spaltung der langen Proteinketten keine Vervielfältigung der Erreger möglich ist, sind virale Proteasen ein wichtiger Ansatzpunkt für Therapeutika. Substanzen, die das aktive Zentrum der Enzyme blockieren (Protease-Inhibitoren), werden in einigen Fällen bereits in der Behandlung eingesetzt. „Die Tatsache, dass sich die HIV-Infektion von einer tödlichen zu einer kontrollierbaren chronischen Krankheit mit hoher Lebenserwartung entwickelt hat, ist wesentlich den Protease-Inhibitoren zu verdanken“, erläutert Klein. Diese sind allerdings nicht universell einsetzbar, sondern müssen für jede Virusgattung spezifisch entwickelt werden.
Normalerweise beginnt die Suche nach effektiven Inhibitoren mit einem biochemischen Testsystem (Assay), in dem chemische Substanzen an der isolierten Virusprotease auf ihre Wirksamkeit geprüft werden. Anschließend werden die identifizierten Moleküle in biologischen Modellen, beispielsweise in mit Viren infizierten Kulturzellen, näher charakterisiert, bevor ihre Effektivität dann an lebenden Organismen untersucht wird. „Leider mussten wir über die Jahre lernen, dass die biochemischen Assays nicht die biologische Wirklichkeit abbilden. Substanzen, die am isolierten Zielprotein wirken, funktionieren häufig nicht, wenn sich die Protease in ihrer biologischen Mikroumgebung in der Zelle befindet“, beschreibt der Pharmazeut die auftretenden Schwierigkeiten. „Dort lokalisiert das Enzym in einem bestimmten Zellbereich oder interagiert mit anderen Proteinen, sodass es nicht mehr so gut zugänglich für die Inhibitoren ist oder in einer etwas anderen 3D-Form vorliegt.“
Reportergen-Assay mit großer Vorhersagekraft
 Auf der Suche nach wirksamen Protease-Inhibitoren entwickelte Prof. Dr. Christian Klein vom IPMB der Universität Heidelberg zusammen mit seinem Team einen zellbasierten Reportergen-Assay. © C. Klein
Auf der Suche nach wirksamen Protease-Inhibitoren entwickelte Prof. Dr. Christian Klein vom IPMB der Universität Heidelberg zusammen mit seinem Team einen zellbasierten Reportergen-Assay. © C. KleinBasierend auf den langjährigen Erfahrungen entwickelte die Heidelberger Arbeitsgruppe nun ein zellbasiertes Untersuchungssystem zur primären Charakterisierung von Substanzen gegen das Dengue-Virus, einen Reportergen-Assay. Hierbei werden keine voll funktionsfähigen, gefährlichen Viren, sondern nur genetische Informationen für die virale Protease in Kulturzellen eingeschleust. Außerdem enthalten die Zellen ein Reporterprotein (hier Luciferase), das über eine virusspezifische Schnittstelle mit einer Sequenz verbunden ist, die den Abbau des Proteins auslöst. Die virale Protease spaltet die Proteinkette und verhindert so den Abbau der Luciferase, deren Aktivität nach Aufschluss der Zellen analysiert wird. Protease-Inhibitoren reduzieren die Spaltung, die Luciferase ist instabil, und ihre Gesamtaktivität in den Zellen nimmt ab.
Da die Wirksamkeit von Hemmstoffen durch einfaches Zugeben der Substanzen zum Kulturmedium untersucht wird, weist ein reduziertes Signal nicht nur auf eine effektive Inhibition der Protease hin, sondern zeigt außerdem, dass die Substanz die Zellmembran durchdringen kann sowie ausreichend stabil und nicht toxisch ist. „Unser Reportergen-Assay hat eine viel bessere Vorhersagekraft als herkömmliche Systeme. Ungeeignete Substanzen werden früh aussortiert“, führt Klein aus. Auf diesem Weg gelang es den Forschenden bereits, Wirkstoffe gegen Dengue-Infektionen zu identifizieren und durch chemische Veränderungen zu optimieren. Sie werden zurzeit in präklinischen Studien getestet.
Für die Übertragung des Reportergen-Assays auf andere Flavi- und auch Coronaviren erhielt Klein im August 2021 eine mit 450.000 Euro dotierte Förderung im Rahmen des Projekts „Virale Zoonosen ‒ Innovative Ansätze in der Wirkstoffentwicklung" von der Volkswagen-Stiftung. Neben dem großen institutionellen Wissen, das in Kombination mit viel Erfahrung im Handling zu einer hohen Reproduzierbarkeit der Experimente führt, war ein weiteres Kriterium für die Bewilligung des Antrags die bereits bestehende enge Zusammenarbeit mit der Protinhi Therapeutics. Die niederländische Firma ist spezialisiert auf Protease-Inhibitoren und untersucht seit einigen Jahren die von der Arbeitsgruppe gefundenen Substanzen in der Präklinik, bzw. entwickelt neue Wirkstoffe, die biochemisch von den Forschenden analysiert werden.
Grundlagenforschung bereitet auf neue Gefahren vor
„Wir machen vor allem Grundlagenforschung. Die hat einen enormen Wert, da sie eine Preparedness für zukünftige Situationen schafft“, erklärt Klein die Strategie seines Labors. „Bei Flaviviren beispielsweise sind die Erkennungssequenzen der Proteasen relativ konstant. Wenn wir jetzt inhibitorische Substanzen entwickeln, dann ist die Chance vorhanden, dass wir beim nächsten neuen Virus schon Hemmstoffe in der Schublade haben.“ Nach dem großen Ausbruch von Zikavirus-Infektionen 2015 in Lateinamerika ermöglichten beispielsweise seine gegen Dengue entwickelten Inhibitoren die schnelle Strukturaufklärung der Protease des Zikavirus.