Biochip-Systeme
Mini-Organe mit großem Potenzial
Jun.-Prof. Dr. Peter Loskill und sein Team vom Fraunhofer-Institut in Stuttgart und der Uniklinik Tübingen entwickeln so genannte „Organ-on-a-Chip“ (OoC). Das sind Mikrofluidik-Systeme, die kleine funktionelle Einheiten von Organgeweben nachbilden. OoC sind vielfältig nutzbar – in der Grundlagen- und Pharmaforschung wie auch in der klinischen Forschung und Anwendung, wo sie künftig manchen Tierversuch überflüssig machen könnten. Auch auf der Suche nach Wirkstoffen gegen das neuartige Coronavirus sind die kleinen Chips im Einsatz.
 Aufbau eines Organ-on-a-Chip – gut zu erkennen sind die Kapillaren und Kammern, die den Chip durchziehen. © Fraunhofer IGB
Aufbau eines Organ-on-a-Chip – gut zu erkennen sind die Kapillaren und Kammern, die den Chip durchziehen. © Fraunhofer IGBMehr als zehn Jahre vergehen im Schnitt, bis ein neues Medikament marktreif ist – zahlreiche Entwicklungsphasen muss ein Wirkstoff bis dahin durchlaufen. Bevor er am Menschen geprüft werden darf, wird seine Sicherheit und Wirksamkeit zunächst eingehend in Laboruntersuchungen (präklinischen Studien) getestet. In dieser Phase der Medikamentenentwicklung kommen die Hersteller um Tierversuche bisher nicht herum. Zwar sind diese in Deutschland streng reguliert, dennoch bewegt das Thema die Gemüter, und der Ruf nach Alternativen ist laut.
Neben ethischen Bedenken gibt es aber auch ganz praktische Gründe dafür, warum alternative Systeme zur präklinischen Medikamentenentwicklung benötigt werden: Die Übertragung von Erkenntnissen aus der Präklinik in die Klinik – die sogenannte Translation – scheitert oft an einer fehlenden Wirksamkeit, toxischen Reaktionen oder anderen unerwünschten Effekten im Menschen. Umgekehrt zeigen einige Wirkstoffe am Tiermodell unerwünschte Reaktionen, die für den Menschen keine Gefahr darstellen. Laborergebnisse und Tierversuche lassen sich also nicht ohne Weiteres auf den Menschen übertragen. Viele Prüfsubstanzen scheitern in späten Entwicklungsphasen, und das kann die Hersteller Millionen kosten.
Organs-on-a-Chip (OoC) sind Mikrofluidik-Kunststoff-Chips, die mit mechanischen und biochemischen Elementen nach dem Auftragen von Gewebezellen kleine funktionelle Organeinheiten nachahmen.
Organchips haben das Potenzial, viele Tierversuche zu ersetzen
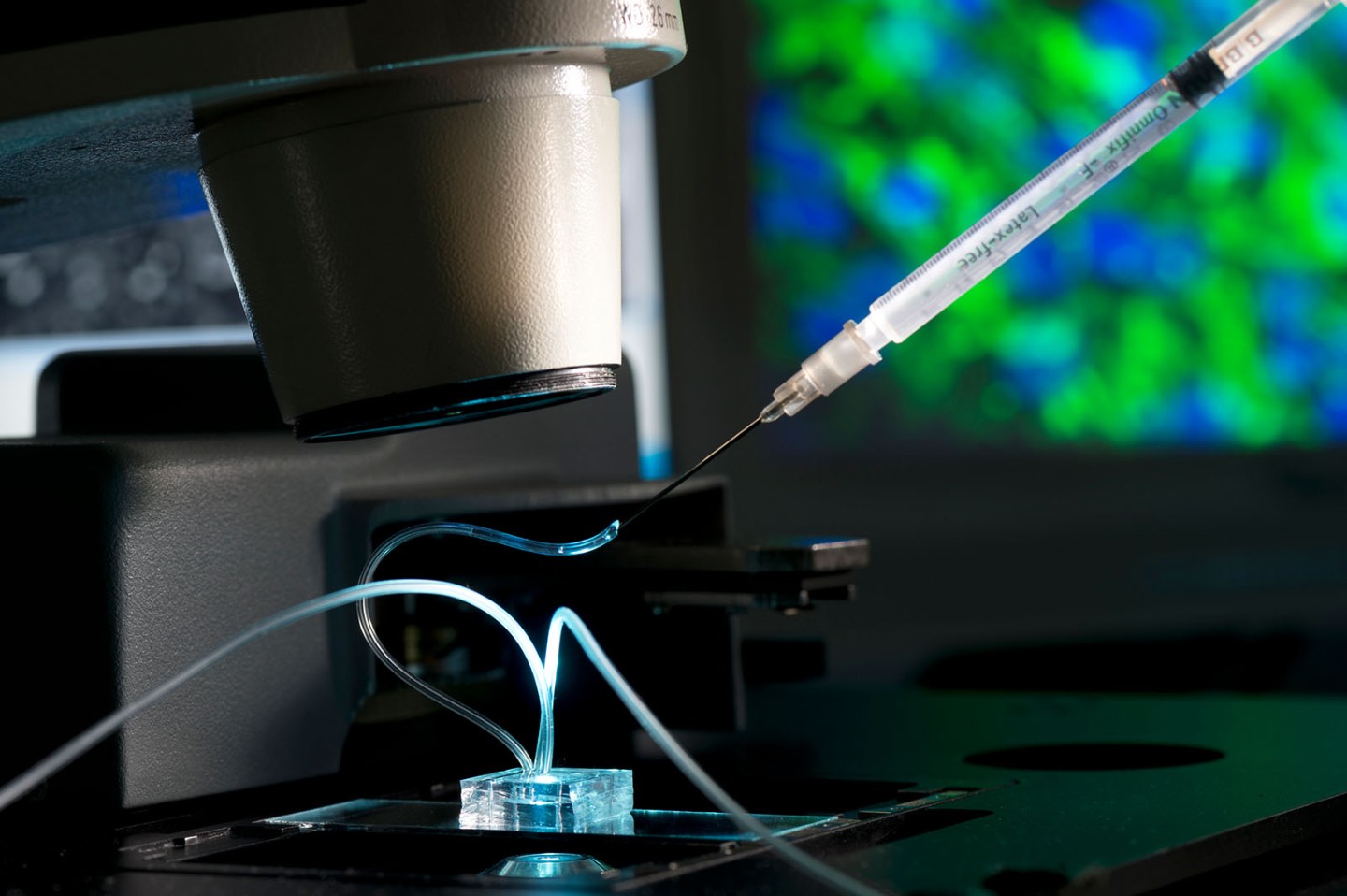 Fettchip unter dem Mikroskop: Mithilfe einer Spritze wird ein Wirkstoff eingebracht, um dessen Effekte auf die Fettzellen zu untersuchen. © Fraunhofer IGB
Fettchip unter dem Mikroskop: Mithilfe einer Spritze wird ein Wirkstoff eingebracht, um dessen Effekte auf die Fettzellen zu untersuchen. © Fraunhofer IGBJun.-Prof. Dr. Peter Loskill, Innovationsfeld-Leiter am Fraunhofer-Institut für Grenzflächen- und Bioverfahrenstechnik IGB in Stuttgart und Juniorprofessor an der Universität Tübingen, forscht mit seinem Team seit vielen Jahren an der Entwicklung von Systemen, die die Struktur und Funktionalität von Organgeweben auf kleiner Fläche nachahmen. Diese „Organ-on-a-Chip“ stellen eine gute Möglichkeit zur Simulierung komplexer physiologischer Vorgänge im Menschen dar und könnten künftig einen Teil der Tierversuche überflüssig machen. „Wir werden Tierversuche in der Arzneimittelentwicklung damit alleine nicht vollständig ersetzen“, betont Loskill, „aber wir werden sie signifikant reduzieren können.“
Bei den Chips handelt es sich um dreidimensionale Mikrofluidik-Systeme, in denen kleinste Kammern und Kanäle vorhanden sind, die aufgrund ihrer mechanischen, geometrischen und biochemischen Eigenschaften die Mikrobedingungen im menschlichen Gewebe nachahmen. Bringt man Zellen in diese Umgebung ein, so kann man dort zusammenhängende Gewebe erzeugen. „Natürlich können wir keine ganzen Organe auf einem Chip nachbilden, wohl aber kleine funktionelle Einheiten von Organen“, erklärt Loskill. Dabei imitieren die Kanäle im Chip Blutgefäße, durch die man zum Beispiel Nährstoffe oder auch Testsubstanzen wie neue Wirkstoffe hindurchspülen kann.
In der klinischen Forschung könnten die Chips helfen, Hinweise darauf zu finden, wie ein bestimmter Patient auf eine Therapie reagiert. Am Universitätsklinikum in Tübingen arbeitet Loskill zusammen mit Dr. André Koch und Prof. Dr. Sara Brucker daran, in solchen 3D-Modellen Tumor-Mikroumgebungen nachzubilden, um dann Brustkrebsgewebe von Patientinnen einzubringen. Im Anschluss testen sie die individuelle Reaktion der Brustkrebsmodelle auf unterschiedliche Krebsmedikamente. „Wenn sich der Ansatz bewährt, ist man dem Ziel einer individualisierten und maßgeschneiderten Krebstherapie ein ganzes Stück näher“, so Loskill.
Breites Einsatzgebiet – nicht nur in der Medikamentenentwicklung
Die kleinen Organ-Einheiten, die auf den OoC nachgebildet werden, werden nicht nur in klinischen Anwendungen eingesetzt, sondern auch in der Grundlagenforschung und in der pharmakologischen Forschung. Einsatzgebiete sind unter anderen:
Funktion von Fettgewebe besser verstehen
Bei einem gesunden Menschen beträgt der Fettanteil im Körper ungefähr ein Viertel, bei einem adipösen (fettleibigen) Menschen sogar bis zu 50 Prozent. Das Fettgewebe macht also einen beträchtlichen Anteil am Gesamtgewebe eines Menschen aus. Seine Bedeutung ist aber noch nicht gut erforscht. Um diese besser zu verstehen und Rückschlüsse auf damit verbundene Erkrankungen wie Adipositas oder Diabetes ziehen zu können, hat Loskill mit seinem Team den „WAT-on-a-Chip" entwickelt. (WAT steht für „White Adipose Tissue"). Damit untersuchen die Wissenschaftler die physiologischen Eigenschaften des Fettgewebes und lernen, Vorgänge wie Stoffeinlagerungen besser zu verstehen.
Wirkstoffe gegen COVID-19 am Lungenmodell testen
Im Juni 2020 hat das Team um Loskill zusammen mit Partnern aus der Fraunhofer-Gesellschaft das Projekt „Fraunhofer vs. Corona“ gestartet: Mit Hilfe eines „Lunge-on-a-Chip" wollen die Wissenschaftler bereits zugelassene Arzneimittel auf ihre pharmakologische Wirkung gegen SARS-CoV-2 hin untersuchen. Der Chip stellt ein Infektionsmodell dar, das die Krankheitsentwicklung (Pathogenese) von COVID‑19 nachbildet. Er soll interessierten Firmen zur Testung eigener Wirkstoffe zur Verfügung gestellt werden.
Organmodellen das Sehen beibringen
Ein ebenfalls neuer und spannender Ansatz aus dem Loskill-Labor ist „Retina-on-a-Chip“. Er simuliert die menschliche Netzhaut (Retina). Gemeinsam mit dem Institut für Neuroanatomie und Entwicklungsbiologie von Prof. Stefan Liebau am Tübinger Universitätsklinikum haben Loskill und sein Team Gewebe aus Stammzellen gewonnen, das unter anderem lichtempfindliche Stäbchen und Zapfen, das Pigmentepithel und Ganglienzellen, die den optischen Nerv bilden, beinhaltet. Nun sind sie dabei, der Retina „das Sehen beizubringen“. Sie konnten nach deren Belichten ein elektrophysiologisches Signal messen – ein Zeichen dafür, dass die Signalübertragung auf dem Chip ähnlich wie in den Nerven des menschlichen Auges funktioniert. „Besonders interessant ist der „Retina-on-a-Chip" für Pharmahersteller“, erklärt. Loskill. Sie können damit untersuchen, ob Arzneistoffe Nebenwirkungen an der Retina verursachen.
So klein ein Organ-on-a-Chip auch ist, so vielfältig sind schon seine Einsatzmöglichkeiten und so groß das Potenzial, das in den Modellen steckt – in der Forschung genauso wie in der Entwicklung. Wenn es gelingt, die physiologischen Bedingungen möglichst genau an die komplexen Gegebenheiten in vivo anzupassen, können die Mini-Organmodelle bald wertvolle Tierversuchsalternativen darstellen, pharmakologische und klinische Studien erleichtern und dabei immense Summen bei der Arzneimittelentwicklung einsparen.