Assay zur Diagnostik von Autoimmunerkrankungen
Pathogenen Immunkomplexen auf der Spur
Im Blut zirkulierende lösliche Komplexe aus Antikörpern und ihren Zielstrukturen können schwerwiegende systemische Entzündungen auslösen. Dr. Philipp Kolb und Haizhang Chen vom Institut für Virologie des Universitätsklinikums Freiburg haben ein sensitives, zellbasiertes Testsystem zum Nachweis dieser Immunkomplexe entwickelt, das bei der Diagnostik von systemischen Autoimmunerkrankungen, aber auch schweren COVID-19-Verläufen, zum Einsatz kommen kann.
Antikörper sind ein wesentlicher Bestandteil unserer erworbenen Immunantwort und werden normalerweise als Reaktion auf den Kontakt mit fremden Strukturen gebildet, wie sie vor allem auf und in Krankheitserregern vorkommen. Sie binden spezifisch an ihr Ziel und locken dadurch Immunzellen an, die die Fremdstoffe eliminieren. Aus noch weitgehend ungeklärten Gründen entstehen gelegentlich Antikörper, die gegen körpereigene Merkmale gerichtet sind. Die hierdurch ausgelösten Autoimmunreaktionen führen zu chronischen Entzündungen und langfristig zur Zerstörung von gesundem Gewebe. Davon sind entweder selektiv einzelne Organe betroffen, wie beispielsweise die Bauchspeicheldrüse bei Diabetes mellitus oder Nervenfasern bei Multipler Sklerose. Oder die Autoantikörper verursachen systemische Erkrankungen wie systemischen Lupus Erythematodes (SLE, Antikörper gegen Zellkernbestandteile) oder Rheumatoide Arthritis (RA, chronische Entzündung der Gelenke), bei denen der ganze Körper in Mitleidenschaft gezogen sein kann.
Lösliche Immunkomplexe rufen systemische Entzündungen hervor
 Das von Dr. Philipp Kolb und Haizhang Chen entwickelte Testsystem kann geringste Mengen an im Blut zirkulierenden löslichen Immunkomplexen nachweisen. © Universität Freiburg
Das von Dr. Philipp Kolb und Haizhang Chen entwickelte Testsystem kann geringste Mengen an im Blut zirkulierenden löslichen Immunkomplexen nachweisen. © Universität FreiburgNach Bindung eines Antikörpers an seine Zielstruktur, das Antigen, entstehen sogenannte Immunkomplexe, die - je nachdem, wo sich das Antigen befindet - entweder immobilisiert an eine Zelloberfläche oder in löslicher Form als sICs (soluble immune complexes) vorkommen. Größe und Zusammensetzung der Immunkomplexe hängen davon ab, wie viele Antikörperbindungsstellen (Epitope) das Antigen besitzt, und in welchem Verhältnis zueinander die Bestandteile vorliegen. In den meisten Fällen treten die Immunkomplexe örtlich begrenzt auf und werden von den Zellen des Immunsystems schnell beseitigt. Sowohl systemische Autoimmunerkrankungen als auch chronische virale oder bakterielle Infektionen gehen allerdings häufig mit im Blut zirkulierenden löslichen Immunkomplexen einher. Diese können sich überall im Körper absetzen und nicht nur lokale Reaktionen und Gewebeschäden hervorrufen, sondern aufgrund der konstanten Aktivierung des Immunsystems auch lebensbedrohliche Entzündungen des gesamten Organismus verursachen. Da der Nachweis der sICs bisher recht schwierig ist, bietet er kaum klinischen Nutzen.
„Mit unserem Assay ist es nicht nur möglich, kleinste Mengen an löslichen Immunkomplexen zu detektieren, sondern auch den Effekt auf das Immunsystem vorherzusagen“,1) erläutert Dr. Philipp Kolb, Gruppenleiter am Institut für Virologie des Universitätsklinikums Freiburg, die Vorteile seines neuen Testsystems. „Erste Untersuchungen an Patientenproben belegen eine direkte Korrelation zwischen unseren Werten und dem klinischen Score, das heißt der Schwere der Erkrankung.“ Das maßgeblich von dem Doktoranden Haizhang Chen entwickelte Verfahren nutzt lebende Zellen, um die Reaktion des Immunsystems nachzubilden.
Fcγ-Rezeptoren zum Nachweis von sICs
Immunglobuline (IGs), so der Fachausdruck für Antikörpermoleküle, haben einen Ypsilon-förmigen Aufbau und besitzen jeweils zwei identische Antigenbindungsstellen. Diese befinden sich an den Enden der beiden „Arme“ und werden von hochvariablen Bereichen gebildet. Deshalb kann jeder Mensch eine Vielzahl dieser Proteine mit unterschiedlichsten Erkennungseigenschaften produzieren. Die „Basis“ der Immunglobuline hingegen ist konstant und variiert nur zwischen den fünf Antikörperklassen. Dieser als Fc-Teil bezeichnete Bereich wird von spezifischen Erkennungsmolekülen, den Fc-Rezeptoren, auf der Oberfläche von Immunzellen gebunden. Die Mehrzahl der im Blut befindlichen Immunglobuline gehört der Klasse G an (IgG) und wird von Fcγ-Rezeptoren erkannt, die sich beispielsweise auf der Oberfläche von Fresszellen (Phagozyten) und natürlichen Killerzellen befinden. Für eine Aktivierung der Immunzellen ist allerdings eine einfache Interaktion zwischen den beiden Molekülen nicht ausreichend, sondern benachbarte Fcγ-Rezeptoren müssen miteinander verknüpft werden, wie es bei der simultanen Bindung verschiedener Antikörper geschieht, die an demselben Antigen haften. Dies löst eine Signalkaskade innerhalb der Immunzelle aus, die zur Ausschüttung von Botenstoffen sowie zytotoxischen Substanzen oder zur Aufnahme der Immunkomplexe durch Phagozytose führt.
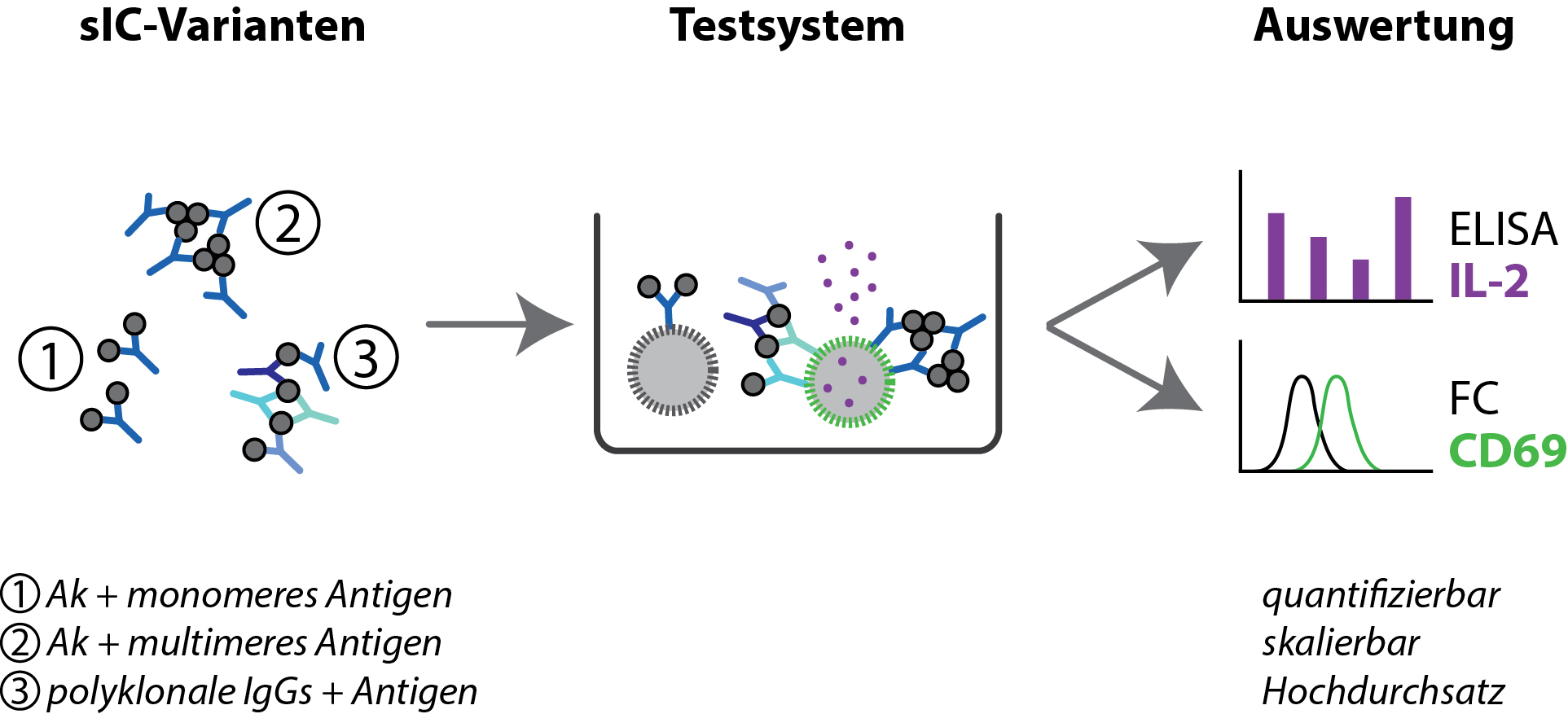 Lösliche Immunkomplexe (sICs) können unterschiedlich groß sein, je nachdem ob das Antigen nur eine Antikörperbindungsstelle/Epitop (1), mehrere identische Epitope (2) oder verschiedene Epitope, die von unterschiedlichen Antikörpern erkannt werden (3), besitzt. Nur die Bindung von sICs, die mehrere Antikörper enthalten, führt zur Aktivierung der Reporterzellen und Ausschüttung von Interleukin-2 (IL-2, lila) sowie Bildung von CD69 (grün). Beide Signale können quantitativ entweder mithilfe der ELISA-Technik oder Durchflusszytometrie (FC) ausgewertet werden.
Lösliche Immunkomplexe (sICs) können unterschiedlich groß sein, je nachdem ob das Antigen nur eine Antikörperbindungsstelle/Epitop (1), mehrere identische Epitope (2) oder verschiedene Epitope, die von unterschiedlichen Antikörpern erkannt werden (3), besitzt. Nur die Bindung von sICs, die mehrere Antikörper enthalten, führt zur Aktivierung der Reporterzellen und Ausschüttung von Interleukin-2 (IL-2, lila) sowie Bildung von CD69 (grün). Beide Signale können quantitativ entweder mithilfe der ELISA-Technik oder Durchflusszytometrie (FC) ausgewertet werden.
Quelle: https://doi.org/10.15252/emmm.202114182, Philipp Kolb, CC-BY 4.0 (https://creativecommons.org/licenses/by/4.0/deed.de), bearbeitet von R. Menßen-Franz.Zum Nachweis der sICs im Blut nutzen die Forschenden genau diese zellulären Signalwege: Sie etablierten ein Modellsystem für primäre Immunzellen, indem sie eine Maus-Reporterzelllinie herstellten, die auf ihrer Oberfläche einen humanen Fcγ-Rezeptor trägt.
Die Erkennung von sICs aktiviert die Zellen und führt dazu, dass sie das Rezeptormolekül CD69 auf ihrer Oberfläche ausbilden und den löslichen Botenstoff Interleukin-2 ausschütten.
Beide Effekte können unabhängig voneinander ausgewertet werden und lassen direkte Rückschlüsse auf die immunstimulierenden Faktoren zu. Kolb erklärt: „Unser System bildet konkret die Aktivierung des Fcγ-Rezeptors ab. Wir messen nicht nur die Bindung der Immunkomplexe an den Rezeptor, sondern sehen genau, in welchem Ausmaß eine Immunzelle darauf reagiert.“ Dadurch konnten die Forschenden zeigen, dass nicht nur die Menge der sICs entscheidend ist, sondern auch ihre Größe. Ein großer Komplex ruft eine deutlich stärkere Zellantwort hervor als mehrere kleine. „Unsere Nachweismethode ist ungefähr tausendmal sensitiver als gängige biochemische Tests, da aufgrund der ausgelösten zellulären Kaskade eine Signalverstärkung stattfindet. Wir können die Entzündungsfaktoren schon sehr früh nachweisen und somit eventuell Autoimmunschübe vorhersagen. Außerdem ist das System stabil und skalierbar. Das heißt, es können sowohl einzelne Proben als auch hunderte gleichzeitig gemessen werden.“ Letzteres ist für die praktische Anwendung in der Klinik von großem Vorteil.
Test zeigt Schweregrad der Erkrankung an
Um die klinische Relevanz des Assays zu untermauern, analysierte Chen das Serum von 25 SLE Erkrankten, die Autoantikörper gegen DNA oder DNA-gebundene Proteine bilden, und in deren Blut sICs zirkulieren. Er konnte eine direkte Korrelation zwischen der Aktivität der Proben im Testsystem und dem Schweregrad der Erkrankung aufzeigen. Untersuchungen von Heidelberger Forschenden an Gelenkflüssigkeitsproben von Personen mit Rheumatoider Arthritis bestätigten mithilfe des Testsystems, dass auch hier sICs eine Rolle bei der Entzündung spielen.2)
Schon früh erkannten Ärztinnen und Ärzte, dass schwere COVID-19-Verläufe große Ähnlichkeit mit Autoimmunerkrankungen wie SLE haben und entsprechende Medikamente gut wirken. Aktuelle Studien unter Verwendung des Testsystems belegen jetzt, dass im Serum der Betroffenen hohe Mengen an sICs vorhanden sind.3) Auch hier korreliert die Schwere der Erkrankung mit der Reaktivität der sICs. Interessanterweise enthalten diese aber keine Coronavirus-Antigene, sondern scheinen sich aus Autoantikörpern gegen unterschiedlichste körpereigene Komponenten zusammenzusetzen. Derzeit läuft eine Pilotstudie mit schwerst Erkrankten, die ermitteln soll, ob der Therapieverlauf über die Präsenz der sICs im Blut verfolgt werden kann und so eine Aussage über den Heilungsgrad zulässt. „Wenn man detektieren kann, wann die Entzündungsfaktoren verschwunden sind, lässt sich die Gabe der oft schwer verträglichen Medikamente unter Umständen minimieren“, führt Kolb aus.
Interdisziplinärer Erfolg
„Der Assay ist ein typisch interdisziplinäres Produkt“, berichtet Prof. Dr. Hartmut Hengel, Leiter des Freiburger Instituts für Virologie. „Wir sind Virologen und untersuchen eigentlich, wie das Cytomegalievirus der Immunkontrolle durch Fc-Rezeptoren entgehen kann. Auf Bitte von Rheumatologen wollten wir ein zellbasiertes System entwickeln, um die Aktivierung anderer Rezeptoren zu messen, was aber nicht funktioniert hat. Deshalb hat Herr Kolb die rheumatologischen Proben einfach in einer von ihm angepassten Version des Fc-Rezeptor-Assays vermessen und einen starken Effekt gesehen.“ In interdisziplinärer Kooperation ist so innerhalb eines Jahres aus dem ungeförderten Nebenprojekt ein Kandidat mit viel Potenzial hervorgegangen. Um die reguläre Anwendung des Testsystems in der klinischen Diagnostik zu ermöglichen, wird deshalb eine zeitnahe Zertifizierung angestrebt.