Bioinspirierte Technologien
Diagnostik mit der Genschere –auch für Vor-Ort-Tests auf COVID-19?
Die Genschere CRISPR-Cas gilt als eine der bedeutendsten molekularbiologischen Entdeckungen der letzten Jahre. Mit ihrer Hilfe können Nukleinsäuren nahezu beliebig editiert werden. Nun haben Freiburger Forscher die Methode erstmals in Deutschland auch erfolgreich zu diagnostischen Zwecken eingesetzt. Derzeit arbeiten sie unter Hochdruck an einer Erweiterung des Systems zur Detektion von Genomsequenzen des neuartigen SARS-CoV-2-Erregers.
Seit 2012 haben Molekularbiologen ein Werkzeug für gezielte Sequenzveränderungen zur Hand: Die Genschere CRISPR-Cas, die auf einem aus Bakterien stammenden Enzymsystem basiert und quasi wie ein Tintenkiller im Genom einzelne Nukleotide oder ganze Sequenzen korrigieren kann. Die Methode wird in der Forschung unter anderem dazu verwendet, um Gene gezielt auszuschalten und damit ihre Funktion untersuchen zu können. Aber auch für Patienten und Verbraucher sind die potenziellen Anwendungsmöglichkeiten groß und reichen von neuartigen medizinischen Therapien über den Einsatz in der Pflanzen- und Tierzüchtung bis hin zur Schädlingsbekämpfung.
Neue Aufgabe für die Genschere
Seit Kurzem kommt noch eine weitere Option hinzu: Freiburger Forscher haben eine Methode entwickelt, um mit Hilfe der Genschere kurze RNA-Sequenzen als Krankheitsmarker - also zu diagnostischen Zwecken - nachweisen zu können. „Bereits seit einigen Jahren arbeiten wir an einer Möglichkeit, um mikroRNAs – miRNAs - schnell und einfach untersuchen zu können. Denn heute weiß man, dass es sich bei miRNAs nicht um Sequenzmüll handelt - wie man das ursprünglich einmal dachte -, sondern dass diese eine wichtige Rolle bei der Genregulation und damit im Krankheitsgeschehen spielen“, berichtet Dr. Can Dincer, der das Projekt am Zentrum für interaktive Werkstoffe und bioinspirierte Technologien (FIT) sowie am Institut für Mikrosystemtechnik (IMTEK) zusammen mit Prof. Dr. Wilfried Weber von der Albert-Ludwigs-Universität leitet. „Hierfür haben wir eine Menge verschiedener Methoden ausprobiert und sind dann letztlich auf die Genschere gestoßen. Der größte Vorteil dabei: Sie ist beliebig programmierbar, und man hat mit ihr einen ganzen Werkzeugkasten zum Nachweis verschiedenster Nukleinsäuren zur Hand.“
Die Anforderungen an eine praktikable Lösung für den Nachweis von miRNA für klinische Zwecke sind hoch, denn für eine gesicherte Diagnose reicht es nicht - wie beispielsweise bei einer Hormonbestimmung - lediglich einen einzigen Wert zu erfassen, sondern es müssen möglichst viele verschiedene miRNAs untersucht werden : „Im Krankheitsfall spielen viele miRNAs zusammen, sind hoch oder herunter reguliert– je nachdem“, erklärt Dincer. „Deshalb war es unser Ziel, möglichst viele gleichzeitig kostengünstig und schnell detektieren zu können. Dafür sollte die Methode zudem in unserem bereits existierenden elektrochemischen mikrofluidischen System, das auf einem Biosensor untergebracht ist, implementiert werden.“
Zuverlässiger Nachweis ganz ohne vorherige Amplifikation
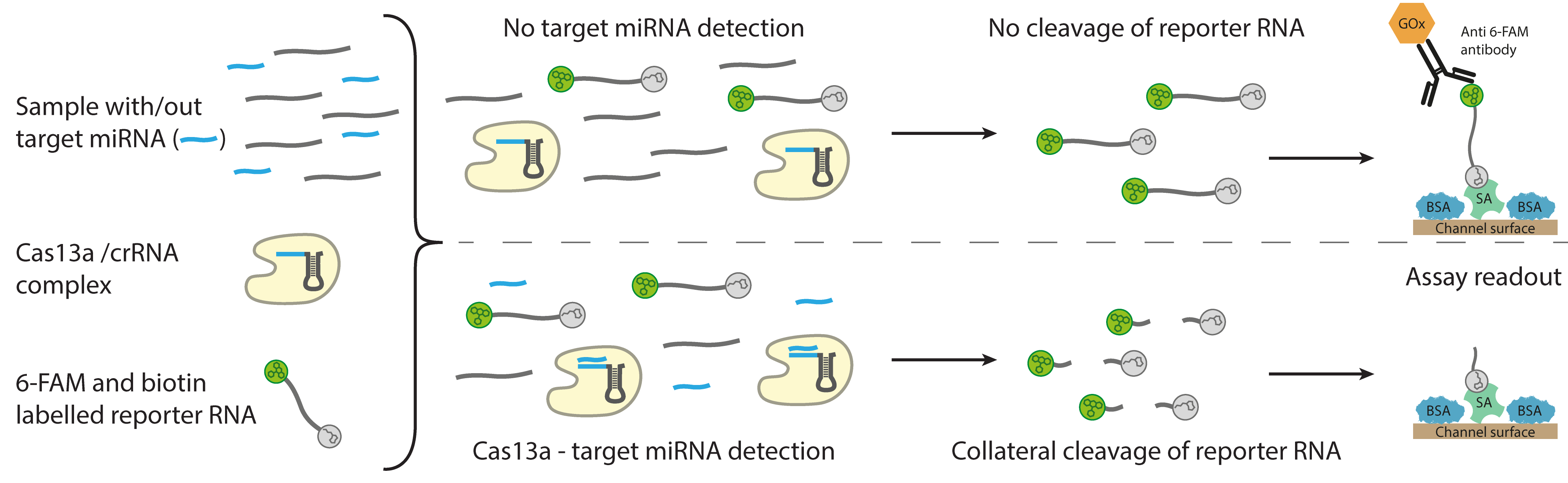 Funktionsprinzip des CRISPR-basierten Assay für die elektrochemische Detektion von microRNA. © Richard Bruch, Universität Freiburg
Funktionsprinzip des CRISPR-basierten Assay für die elektrochemische Detektion von microRNA. © Richard Bruch, Universität FreiburgDie gängige Methode der Wahl, um mi-RNA zu detektieren, ist aktuell die qPCR (Real Time Quantitative PCR), die die Forscher zunächst auch mit dem Biosensor testeten. „Allerdings gibt es hier das Problem, dass dies mit langen Nukleinsäurestücken gut, mit den kurzen, nur 18 bis 22 Basenpaaren langen miRNAs allerdings nicht so gut und einfach funktioniert“, sagt der Freiburger Nachwuchsgruppenleiter. „Deshalb haben wir nach Alternativen gesucht und sind letzten Endes auf das CRISPR-Cas13a-System gestoßen. Diese hat viele Vorteile: zum Beispiel kommt sie – im Gegensatz zur qPCR – ohne die Vervielfältigung der miRNA aus. Man braucht auch keine speziellen Geräte und Chemikalien. Dies macht das System günstig und erheblich schneller als andere Techniken.“
Für die Untersuchung wird die Probe - etwa ein Tropfen Serum, die natürlicherweise viele verschiedene Targets (zum Beispiel miRNAs) enthält, lediglich mit einer Reaktionslösung gemischt und auf den Mikrofluidik-Chip – den CRISPR-Biosensor - getropft. Ist die gesuchte miRNA in der Probe enthalten, so bindet sie über eine komplementäre CRISPR-RNA an die Genschere Cas13a in der Lösung und aktiviert sie somit – ähnlich wie ein Schlüssel ein Schloss aufschließt. Die aktivierte Genschere schneidet dann die auch in der Lösung vorhandenen Reporter-RNAs, die letztendlich jeweils mit einem Enzym versehen werden. Und dies kann wiederum elektrochemisch in einer Glukose-gekoppelten Reaktion gemessen werden und damit anzeigen, ob der gesuchte Biomarker – die miRNA - in der Probe nachzuweisen ist: Und zwar nimmt die Stromstärke mit einer steigenden Konzentration der gesuchten miRNA ab.
Mit dem CRISPR-Biosensor erfolgreich Erkrankung diagnostiziert
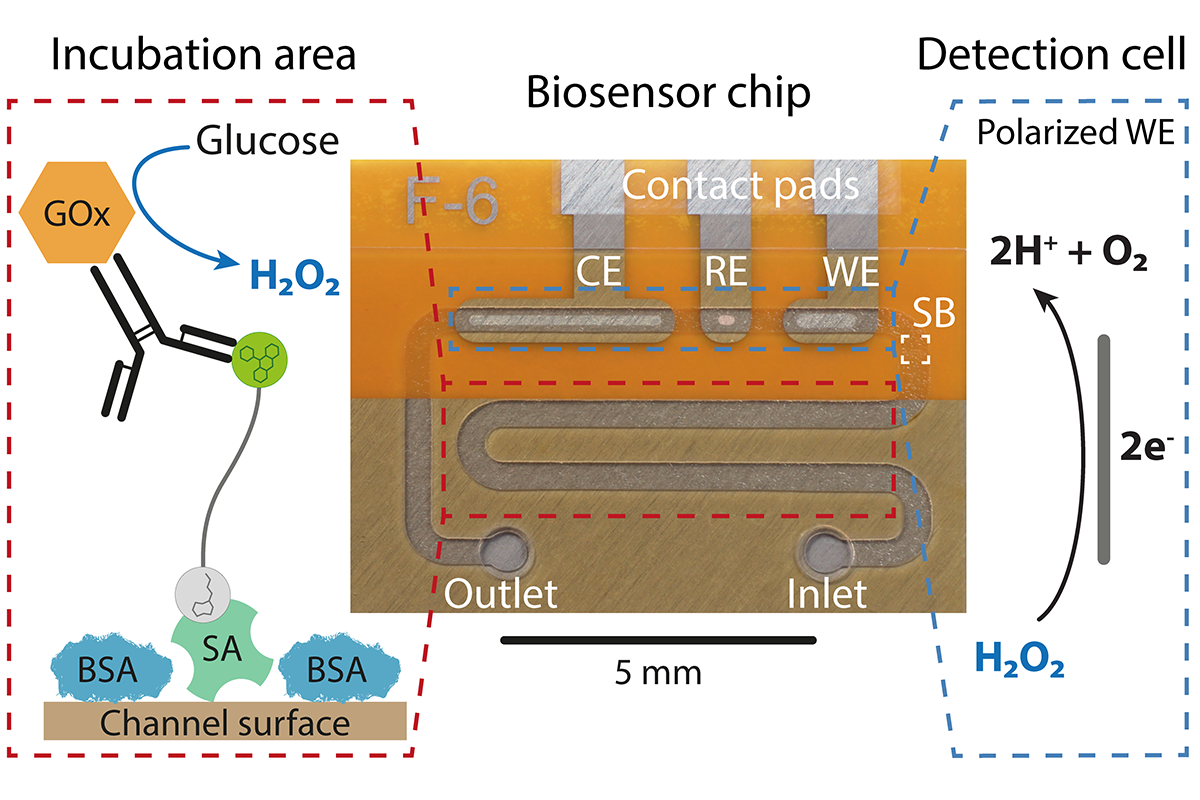 Der mikrofluidische CRISPR-Biosensor misst eine Änderung der Stromstärke, sobald die gesuchte miRNA als Krankheitsmarker in der Patientenprobe enthalten ist. © Richard Bruch, Universität Freiburg
Der mikrofluidische CRISPR-Biosensor misst eine Änderung der Stromstärke, sobald die gesuchte miRNA als Krankheitsmarker in der Patientenprobe enthalten ist. © Richard Bruch, Universität FreiburgDincer und sein Team waren unter den ersten, die auf die Idee kamen, das CRISPR-Cas13a-System auch zu diagnostischen Zwecken einzusetzen. „Als wir 2017 mit den Entwicklungsarbeiten begannen, gab es weltweit nur vielleicht ein oder zwei andere Gruppen, die sich damit beschäftigten“, meint er. „Es ist nämlich nicht so einfach, das Enzym herzustellen, man kann es nicht einfach kaufen, weil die Patentfrage noch nicht geregelt ist. Das ist übrigens auch einer der Gründe, warum das System erst jetzt zu diagnostischen Zwecken genutzt wird. Wir in Freiburg sind aber in der glücklichen Lage, dass Prof. Weber mit seiner Arbeitsgruppe den biologischen Part im Projekt übernommen hat und er Cas13a für unsere Zwecke maßschneidert. Das ist überhaupt das Tolle an Freiburg, dass man eine Vielzahl an Synergien für solche Arbeiten nutzen kann.“
Mit Erfolg: Der nach nunmehr zwei Jahren entwickelte CRISPR-Biosensor ist der erste elektrochemische Sensor weltweit, der die Genschere zu diagnostischen Zwecken nutzt. „Dass dies bestens funktioniert, konnten wir bereits anhand konkreter klinischer Fragestellungen zeigen: wir konnten damit erfolgreich tumorspezifische miRNAs in Proben von Patienten nachweisen, die an Gehirntumor litten“, sagt Dincer. „Unser System hat durch die Programmierbarkeit der Genschere den großen Vorteil, dass es enorm flexibel ist. Der Chip an sich bleibt für alle Anwendungen gleich. Man muss nur das „Schloss“ der Genschere ändern, und schon ist sie individuell angepasst. Das ist eine sehr attraktive und einfache Lösung. Das „Schloss“ müssen wir zwar noch etwas „polieren“; es gibt da durchaus noch Verbesserungspotenzial, aber am Ende wird die Technik zuverlässig und flexibel funktionieren.“
Erweiterung des Systems für COVID-19-Tests
Generell seien die Bedingungen zur praktischen Durchführung der Untersuchung sehr einfach, wie Dincer betont: „Man braucht nicht viel an Ausstattung, denn es findet ja keine Amplifikation und auch kein Rühren oder Schütteln statt – es sind lediglich wenige Stunden Schneidezeit für das Enzym, die man erübrigen muss, und dann benötigt man natürlich das Gerät selbst, das aber nicht sehr komplex und teuer ist. Wir haben es im Prinzip auch schon fertig entwickelt und sind gerade dabei, einen Prototyp zu bauen. Diesen Prototyp wollen wir dann so weiter entwickeln, dass wir irgendwann einmal möglichst ein portables Tischgerät für die Arztpraxis anbieten können, in dem ein Tropfen Blut völlig automatisch analysiert wird.“
Solche weiteren Arbeiten müssen aber erst einmal zurückstehen. Denn die Freiburger Forscher setzen derzeit große Hoffnungen auf die Genschere zur Bewältigung der enormen Menge an Tests auf das neuartige Corona-Virus: „Wir versuchen gerade, unser Cas13a-basiertes Messsystem so zu erweitern, dass wir zwei charakteristische Genomsequenzen des SARS-CoV-2-Erregers (COVID-19), die von der Berliner Charité für Tests vorgeschlagen wurden, gleichzeitig detektieren können“, berichtet der Experte. „Der hierfür verwendete Multiplex-Ansatz bietet im Vergleich zur bisher üblichen Vorgehensweise einen klaren zeitlichen Vorteil in der Untersuchung der Proben von einem Rachenabstrich, da Screening, Bestätigung und Ausschluss einer möglichen Infektion mit SARS-CoV simultan ablaufen. Dabei streben wir eine Gesamtdauer des Tests von unter 45 Minuten an. Dies bieten zwar auch vergleichbare Systeme derzeit; unser Verfahren arbeitet aber ohne Nukleinsäure-Amplifizierung, das heißt die Hands-on-time ist wesentlich kürzer als bei den bisherigen Verfahren. Und es bietet eine schnelle zukünftige Anpassung auf jegliche RNA-Sequenzen – ist somit ideal, um mit potenziellen Mutationen des Coronavirus Schritt zu halten. In spätestens vier Wochen werden wir wissen, ob das so funktioniert wie wir es erwarten.“
Große Alzheimer-Studie steht an
Steht der neuartige Corona-Test einmal, planen die Wissenschaftler, in den nächsten Jahren zunehmend klinische Forschungsarbeiten durchzuführen. Geplant sind unter anderem Studien mit den Proben vieler Patienten: „Die erste Fragestellung, die wir mit dem Biosensor schon erfolgreich bewältigt haben, war die Diagnostik bestimmter Krebserkrankungen (*)“, sagt Dincer. „Nach der Krise wollen wir gemeinsam mit Prof. Michael Heneka von dem Deutschen Zentrum für Neurodegenerative Erkrankungen (DZNE) nach miRNAs suchen, die eine frühere Diagnose der Alzheimer-Erkrankung ermöglichen als mit bisherigen Krankheitsmarkern.“
Parallel dazu steht in den nächsten Jahren die Vermarktung der Technik an. Finde man eine große Firma mit der entsprechenden Erfahrung, dann könnte der Biosensor spätestens in fünf Jahren auf dem Markt sein. Falls nicht, denke man über ein eigenes Startup nach – dies würde dann länger dauern, meint der Wissenschaftler.
Videoquelle: Supplementary video of article "CRISPR/Cas13a-Powered Electrochemical Microfluidic Biosensor for Nucleic Acid Amplification-Free miRNA Diagnostics", published in Advanced Materials (DOI: 10.1002/adma.201905311)
© Ella Maru Studio / Universität Freiburg