Voll-Enzym-Hydrogele im Einsatz
Biokatalytische Schäume ermöglichen die nachhaltige Synthese komplexer Moleküle
Konventionelle chemische Syntheseprozesse verbrauchen viel Energie und umweltschädigende Lösungsmittel. Die Arbeitsgruppe von Prof. Dr. Christof Niemeyer vom Karlsruher Institut für Technologie hat aus vernetzten Enzymen poröse, feste Schäume generiert, die die Produktion hochwertiger Verbindungen unter deutlich umweltschonenderen Bedingungen erlauben. Die neuartigen Biokatalysatoren sind zudem extrem widerstandsfähig und lange haltbar.
Die Mehrzahl der industriell hergestellten Arzneistoffe und Kosmetika, aber auch Kunststoffe, Waschmittel oder Dünger basieren auf anorganischen und organischen Grundchemikalien. Hierzu zählen beispielsweise Schwefelsäure, Chlor, Natronlauge oder Ammoniak bzw. Ethylen, Propylen oder Methanol. Sowohl die Synthese dieser einfach aufgebauten Verbindungen aus fossilen Rohstoffen als auch ihre Weiterverarbeitung erfordern viel Energie und große Mengen an gesundheitsgefährdenden und umweltschädlichen Lösungsmitteln. Um die chemischen Reaktionen zu beschleunigen bzw. die Produktion bestimmter Varianten zu fördern, kommen zudem häufig metallhaltige Katalysatoren zum Einsatz. Obwohl die chemische Industrie in Deutschland ihre Treibhausgasemissionen zwischen 1990 und 2018 schon um 51 Prozent gesenkt hat, ist der CO2-Fußabdruck der Prozesse immer noch sehr hoch.1) Allein die Produktion der Grundchemikalien setzt jährlich etwa 37 Mio. t CO2-Äquvalente frei und damit 19 Prozent der gesamten Industrieemissionen Deutschlands.
Durch den Einsatz sogenannter Plattformchemikalien, also aus nachwachsenden Rohstoffen hergestellten Grundchemikalien, lassen sich Ressourcen einsparen und die Klimabilanz verbessern. Da deren Produktion aber mit höheren Kosten verbunden ist, ist ihr Anteil in der Chemieindustrie mit ungefähr 15 Prozent (2017) immer noch sehr gering.2)
Umweltfreundliche Biokatalyse
 Dr. Kersten Rabe, der Doktorand Julian Hertel und Prof. Dr. Christof Niemeyer entwickelten am Institut für Biologische Grenzflächen des KIT neuartige biokatalytische Schäume. © KIT
Dr. Kersten Rabe, der Doktorand Julian Hertel und Prof. Dr. Christof Niemeyer entwickelten am Institut für Biologische Grenzflächen des KIT neuartige biokatalytische Schäume. © KITAuch für die energieintensive und schadstoffreiche Weiterverarbeitung müssen Alternativen gefunden werden. Hier setzt die Forschung von Prof. Dr. Christof Niemeyer an, dem Direktor des Instituts für Biologische Grenzflächen (IBG-1) am Karlsruher Institut für Technologie (KIT). „Mit Hilfe von Enzymen wollen wir chemische Syntheseprozesse nachhaltiger machen. Die biologischen Katalysatoren haben eine hohe Spezifität und stellen nur bestimmte Isomere [Strukturvariante eines Moleküls, Anm. d. Red.] her. Mit konventionellen Methoden ist dies kaum zu kontrollieren, weshalb viele wertlose Nebenprodukte entstehen.“ Vor allem aber können enzymkatalysierte Reaktionen in wässrigem Milieu und bei niedrigen Temperaturen ablaufen, sodass sie preisgünstiger und deutlich umweltschonender sind.
Sowohl chemische als auch biologische Katalysatoren ermöglichen bzw. beschleunigen die Stoffumsetzung, indem sie die erforderliche Aktivierungsenergie herabsetzen. Beide gehen dabei unverändert aus der Reaktion hervor. Sie werden daher nur in geringen Mengen benötigt und wirken so lange bis das chemische Gleichgewicht erreicht ist. Werden die Katalysatoren allerdings an ein Trägermaterial gebunden und die Reaktanten fließen vorbei, sind kontinuierliche Prozesse möglich. Dieses Verfahren stellt vor allem bei Enzymen eine besondere Herausforderung dar, denn jede Veränderung der dreidimensionalen Struktur beim Immobilisieren kann zu Aktivitätsverlusten führen.
Voll-Enzym-Hydrogele für effiziente Umwandlung
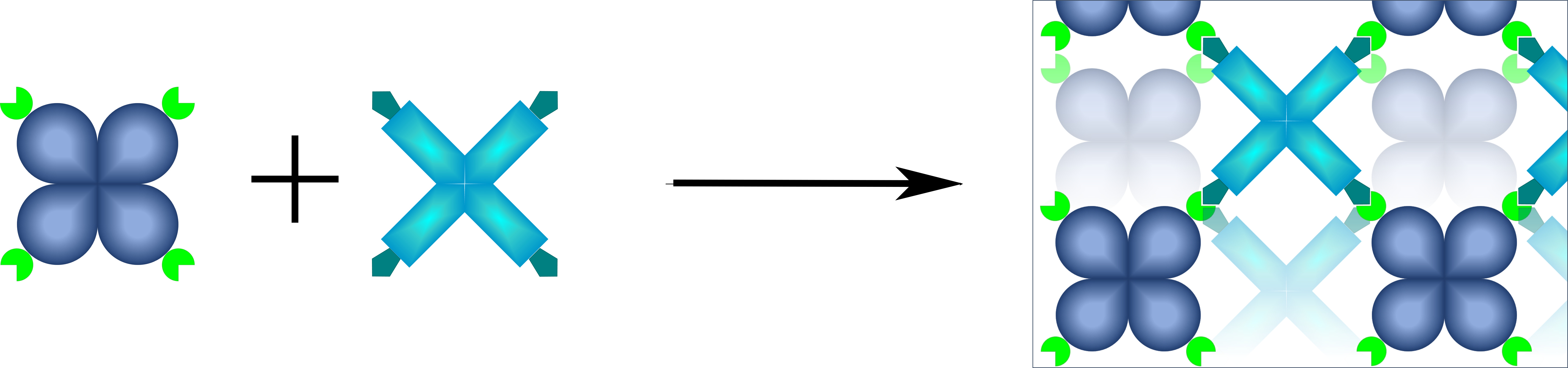 Die mit unterschiedlichen Tags versehenen Enzym-Tetramere bilden unter physiologischen Bedingungen spontan ein gleichmäßiges, poröses Netzwerk aus, ein Voll-Enzym-Hydrogel. © KIT
Die mit unterschiedlichen Tags versehenen Enzym-Tetramere bilden unter physiologischen Bedingungen spontan ein gleichmäßiges, poröses Netzwerk aus, ein Voll-Enzym-Hydrogel. © KIT„Für hohe Umsätze sollte außerdem möglichst viel Katalysator pro Reaktorvolumen vorhanden sein“, schildert Niemeyer weitere Anforderungen. „Wir befassen uns seit einiger Zeit mit dieser Thematik und haben bereits vor fünf Jahren sogenannte Voll-Enzym-Hydrogele entwickelt.“ Hierbei handelt es sich um dreidimensionale poröse Polymere aus miteinander verknüpften Enzymen3). Für die Synthese spezifischer Alkoholisomere bei paralleler Regeneration des notwendigen Cofaktors NADPH nutzte sein Team zwei bakterielle Enzyme: eine Alkohol-Dehydrogenase (ADH) aus Lactobacillus brevis und eine Glucose 1-Dehydrogenase (GDH) aus Bacillus subtilis.
An beide Proteine wurden im Labor zusätzliche, aber unterschiedliche Aminosäuresequenzen angefügt, sogenannte Tags. Treffen zwei dieser ungleichen Tags zusammen, reagieren sie spontan miteinander und bilden eine feste Verbindung. Da jedes Enzym mit drei weiteren seiner Art in einem Komplex vorliegt (Homo-Tetramer), der dementsprechend vier Verknüpfungsstellen besitzt, entsteht beim Vermischen ein vernetztes poröses Enzympolymer. Wird das Voll-Enzym-Hydrogel dann in den Kanal eines mikrofluiden Chips gefüllt und anschließend Substratlösung durchgeleitet, erfolgt eine nahezu vollständige Umsetzung des Substrats zum gewünschten Produkt. „Wir erreichen mit unserem Ansatz eine hohe Enzymkonzentration, da kein zusätzliches Trägermaterial nötig ist. Außerdem sind die Hydrogele sehr widerstandsfähig gegenüber den Durchflussbedingungen im Reaktor“, beschreibt Dr. Kersten Rabe, Arbeitsgruppenleiter am IGB-1 und Mitautor3), die Vorteile.
Neuartige Enzymschäume ermöglichen effiziente Durchfluss-Biokatalyse
 Durch Aufschäumen des Voll-Enzym-Hydrogels mit Stickstoff entstehen Blasen (links), die sich beim Trocknen (rechts) zu einem regelmäßigen, hexagonalen Gitter mit einem hohen Oberfächen-Volumen-Verhältnis verfestigen (Fluoreszenzmikroskopische Aufnahme). Quelle: doi:10.1002/adma.202303952, Julian S. Hertel | Karlsruher Institut für Technologie (KIT), CC-BY-NC-ND 4.0 (https://creativecommons.org/licenses/by-nc-nd/4.0/deed.de)
Durch Aufschäumen des Voll-Enzym-Hydrogels mit Stickstoff entstehen Blasen (links), die sich beim Trocknen (rechts) zu einem regelmäßigen, hexagonalen Gitter mit einem hohen Oberfächen-Volumen-Verhältnis verfestigen (Fluoreszenzmikroskopische Aufnahme). Quelle: doi:10.1002/adma.202303952, Julian S. Hertel | Karlsruher Institut für Technologie (KIT), CC-BY-NC-ND 4.0 (https://creativecommons.org/licenses/by-nc-nd/4.0/deed.de)Das Enzympolymer bildet allerdings sehr kleine Poren, sodass der Stofftransport limitiert ist. Um die Durchflussgeschwindigkeit und das Oberflächen-Volumen-Verhältnis zu steigern, schäumten die Forschenden die Gele deshalb in den Chips mit Stickstoff auf. „Die Etablierung der Prozedur war nicht trivial, denn die Enzyme dürfen ihre dreidimensionale Struktur nicht verlieren“, erläutert Doktorand Julian Hertel, Erstautor der im September 2023 im renommierten Fachjournal Advanced Materials publizierten Ergebnisse.4) „Aber inzwischen stellen wir die monodispersen [mit Blasen einheitlicher Größe, Anm. d. Red.] Schäume routinemäßig her.“
Vor dem Einsatz im Minireaktor müssen die Chips etwa vier Wochen trocknen. Dies geschieht unproblematisch bei Raumtemperatur und unter Umgebungsluft. Die Bläschen verfestigen sich dabei unter Ausbildung eines sehr regelmäßigen hexagonalen Gitters. „Die getrockneten Schäume sind physisch und chemisch unglaublich stabil, die Enzyme zeigen teilweise sogar eine höhere Aktivität als in den frischen Gelen“, schwärmt Niemeyer. Bisher wandten die Forschenden das Verfahren erfolgreich bei zwei völlig unterschiedlichen Enzymsystemen an. Der Chemiker ergänzt: „Die unkomplizierte Lagerung, die lange Haltbarkeit und die Übertragbarkeit auf andere Enzymklassen ist eine wichtige Voraussetzung für eine zukünftige industrielle Nutzung des Verfahrens.“ Ein Patent ist bereits beantragt, und die Forschenden denken über eine Ausgründung nach.
Aktuell versucht das Team, die Stabilisierung der Schäume noch weiter zu erhöhen, da beim Durchströmen der Flüssigkeit massive mechanische Scherkräfte wirken. Außerdem wurde das Verfahren bereits auf Proteine übertragen, die nicht als Tetramer vorliegen.5) „Wir haben sehr viel Erfahrung im Protein-Engineering“, hebt Rabe hervor. „Wenn man zwei Tags pro Enzym einfügt, kann man auch Dimere stabil vernetzen. Auch höhere Multimerisierungsgrade sind möglich.“
Mit Hilfe der innovativen biokatalytischen Schäume könnten zukünftig viele chemische Syntheseprozesse nachhaltiger gestaltet werden. Das bisher im Labormaßstab erprobte unkomplizierte Verfahren sollte sich problemlos hochskalieren lassen. Die konkreten Kosten hängen vor allem von den benötigten Enzymen ab, deren Produktion in den meisten Fällen noch deutlich teurer ist als die von chemischen Katalysatoren. „Bei konventionellen Methoden werden jedoch häufig die Kosten für die Entsorgung der umweltschädigenden Abfälle nicht mit einberechnet“, gibt Niemeyer zu bedenken. Die Industrie zeigt bereits großes Interesse an dem neuartigen Verfahren, das vor allem bei der Synthese komplexer Moleküle sehr effizient ist.