Trenzyme GmbH
Das SARS-CoV-Spike-Protein und sein Rezeptor
Mithilfe seines Spike-Proteins bindet das Coronavirus SARS-CoV-2 an den Rezeptor ACE2 auf den Zelloberflächen des Lungengewebes. Weitere Kofaktoren sind nötig, damit das Virusgenom in die Zellen eindringen und vermehrt werden kann. Die Kenntnis dieser Zusammenhänge kann helfen, den Verlauf der Infektion zu verstehen und Gegenstrategien zu entwickeln. Das Konstanzer Unternehmen Trenzyme hat dazu ein rekombinantes Spike-Protein zur Unterstützung der Coronavirus-Forschung hergestellt.
Nachdem alle Informationen über eine neuartige Lungenkrankheit in der zentralchinesischen Stadt Wuhan im Dezember 2019 zunächst rigoros unterdrückt und bedroht worden waren, wurde die Weltgesundheitsorganisation (WHO) schließlich am 31.12.2019 von den chinesischen Behörden in Kenntnis gesetzt, dass es zu mehreren Fällen einer Lungenerkrankung (Pneumonie) unbekannter Ursache gekommen sei. Schon eine Woche später reichten chinesische Wissenschaftler bei der renommierten Fachzeitschrift „Nature“ eine Publikation ein (online publiziert am 3. Februar 2020), in der auf der Basis einer Genomanalyse ein neuartiges, mit dieser Pneumonie assoziiertes Coronavirus beschrieben wurde, das später auf den Namen SARS-CoV-2 getauft wurde und sich als Verursacher der verheerenden COVID-19-Pandemie weltweit verbreitet hat.
Propaganda und freie Kommunikation von Wissenschaft
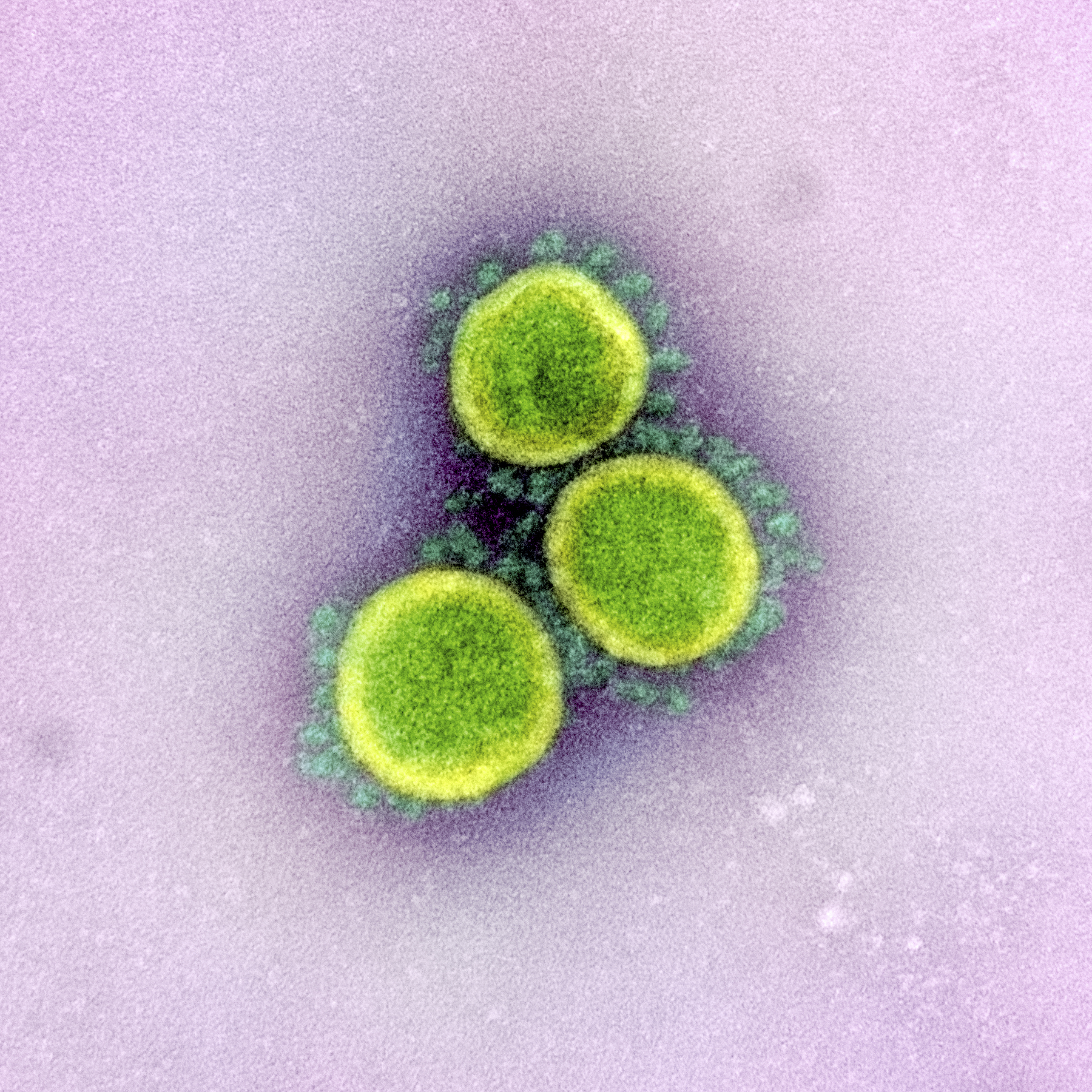 Das Coronavirus SARS-CoV-2, elektronenmikroskopische Aufnahme (nachkoloriert). Lizenz: CC-O (public domain; ID: 2294135), ursprüngliche Quelle: US Government departement, the National Institute of Allergy and Infection Diseases
Das Coronavirus SARS-CoV-2, elektronenmikroskopische Aufnahme (nachkoloriert). Lizenz: CC-O (public domain; ID: 2294135), ursprüngliche Quelle: US Government departement, the National Institute of Allergy and Infection DiseasesDie Wissenschaftler hatten das Virus aus einem am 20. Dezember 2019 erkrankten und eine Woche später ins Krankenhaus eingelieferten Patienten isoliert, der auf einem Fischmarkt in Wuhan gearbeitet hatte, auf dem auch lebende und an Ort und Stelle geschlachtete Wildtiere verkauft wurden. Vergleichende Genomanalysen brachten die Forscher zu dem Schluss, dass SARS-CoV-2 (ähnlich wie sein Vorläufer, das SARS-Coronavirus von 2003) ursprünglich von Fledermäusen stammte und über einen auf dem Markt gehandelten Zwischenwirt - möglicherweise ein Pangolin (Schuppentier) – auf den Menschen übergesprungen war. Der Fischmarkt wurde am 1. Januar 2020 geschlossen und wenig später der Handel mit Wildtieren auf chinesischen Märkten von der Zentralregierung in Beijing verboten. Das sei hier vermerkt, weil offizielle Sprecher derselben Regierung ab Mitte März 2020 Verschwörungstheorien aufgriffen, wonach das Virus durch die USA nach China eingeschleppt worden sei. Zu diesem Zeitpunkt war die erste große Infektionswelle in Zentralchina dank der „ambitioniertesten, agilsten und aggressivsten Bemühungen zur Krankheitseindämmung in der Geschichte“ (so der WHO-Abschlussbericht vom März 2020), wie es scheint, unter Kontrolle gebracht, und Chinas lebenslanges Staatsoberhaupt Xi Jinping lässt sich als Sieger über das Coronavirus und Vorbild für die jetzt von der Seuche erschütterten Länder feiern.
Man kann vor diesem Hintergrund gar nicht genug loben, wie schnell die chinesischen Wissenschaftler die vollständige RNA-Sequenz von SARS-CoV-2 zur Verfügung stellten, auf deren Basis beispielsweise im Labor von Prof. Dr. Christian Drosten am Institut für Virologie der Berliner Charité schnell ein RT-PCR (Reverse-Transkriptase-Polymerase-Kettenreaktion)-Test für den genauesten, inzwischen universell verwendeten Nachweis des Virus entwickelt und validiert werden konnte. Ebenso kann anhand der publizierten molekularen Daten gezielt nach wirksamen Impfstoffen und Medikamenten zur Bekämpfung der Covid-19-Pandemie gesucht werden, an deren Entwicklung jetzt mit Hochdruck gearbeitet wird.
Die Spikes der Coronaviren
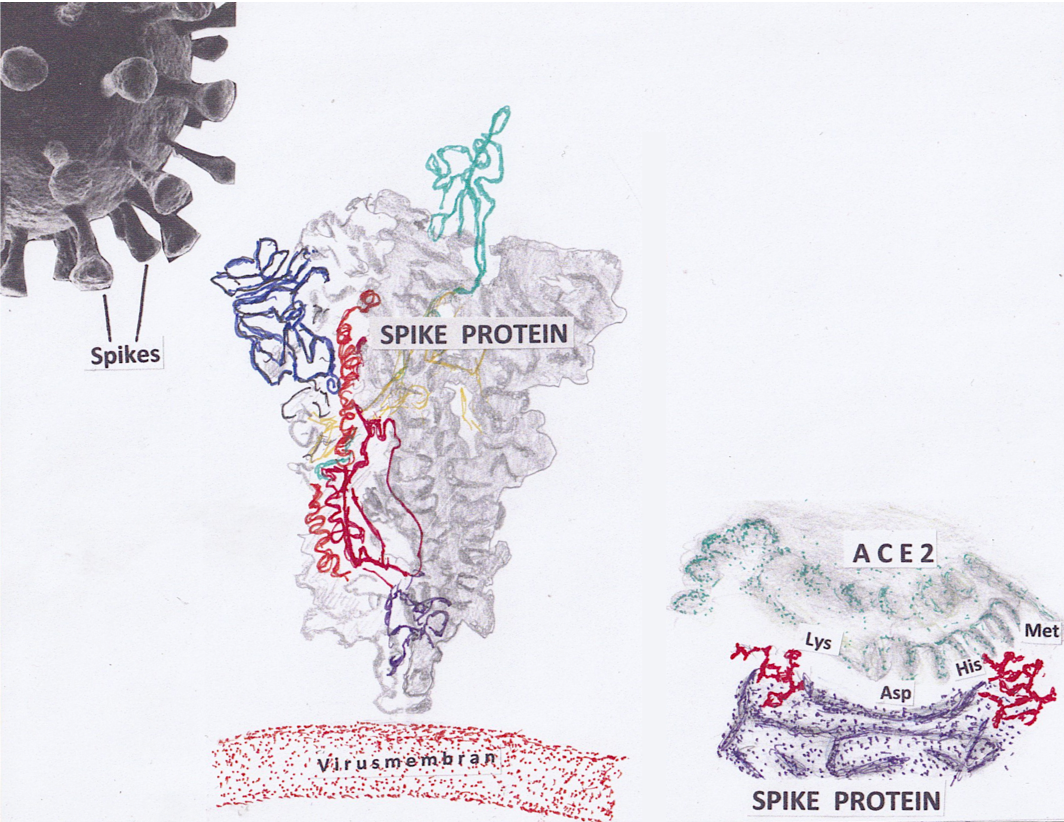 Spikes und Spike-Protein von SARS-CoV-2. Links: Kryoelektronenmikroskopische Struktur des Spike-Proteins in der Konformation vor seiner Fusion mit der menschlichen Zellmembran. Einzelne Proteindomänen sind koloriert; grün die Rezeptor-Bindungsdomäne (RBD). Rechts unten: Die Kopplung zwischen der RBD des Spike-Proteins mit den Bindungsstellen des ACE-2-Rezeptors; durch Konformationsänderung treten die Zuckerketten des Spike-Proteins (rot) mit dem Rezeptor in Kontakt. © EJ nach Wrapp et al. (2020)
Spikes und Spike-Protein von SARS-CoV-2. Links: Kryoelektronenmikroskopische Struktur des Spike-Proteins in der Konformation vor seiner Fusion mit der menschlichen Zellmembran. Einzelne Proteindomänen sind koloriert; grün die Rezeptor-Bindungsdomäne (RBD). Rechts unten: Die Kopplung zwischen der RBD des Spike-Proteins mit den Bindungsstellen des ACE-2-Rezeptors; durch Konformationsänderung treten die Zuckerketten des Spike-Proteins (rot) mit dem Rezeptor in Kontakt. © EJ nach Wrapp et al. (2020)SARS-CoV-2 und verwandte Coronaviren zeichnen sich durch stachelartige Fortsätze („Spikes“) auf ihrer Oberfläche aus, die ihnen ihr - mittlerweile weltbekanntes - Aussehen verleihen, das entfernt an die Corona bei einer totalen Sonnenfinsternis erinnert. Die Spikes bestehen aus einem Glykoprotein, mit dem das Virus an einen Rezeptor der Wirtszelle gekoppelt wird. Amerikanische Wissenschaftler um Jason McLellan an der University of Texas haben mit Elektronenmikroskopie bei ultratiefen Temperaturen gezeigt, dass das Spike-Protein mit der Kopplung seine Konformation ändert und in die menschliche Zellmembran eingebaut wird. So kann das Virusgenom in die Zelle eindringen und sich dort vermehren. Das Spike-Protein steht deshalb bei der Entwicklung von Impfstoffen ebenso wie bei der Suche nach wirksamen Medikamenten gegen eine Corona-Infektion im Brennpunkt der Forschung.
Aus Untersuchungen von Drosten an der Berliner Charité und anderen weiß man, dass das Spike-Protein der SARS-Coronaviren an einen Rezeptor namens ACE2 (Angiotensin-converting enzyme 2) bindet, ein Enzym, das auf den Zelloberflächen des Lungengewebes in hoher Dichte vorkommt. McLellan und Mitarbeiter führten vergleichende Strukturanalysen und Bindungsstudien der Spike-Proteine verschiedener Coronaviren durch und wiesen nach, dass SARS-CoV-2 eine zehnmal höhere Bindungsaffinität zu ACE2 hat als das frühere SARS-CoV-1 von 2003. Antikörper, die an das Spike-Protein von SARS-CoV-1 binden, zeigten keine Affinität zum Spike-Protein von SARS-CoV-2. Mit der starken Bindung an ACE2 hängt auch zusammen, dass manche Patienten an dem neuen Coronavirus so schwer erkranken oder an akutem Lungenversagen sterben. Die physiologische Funktion von ACE2 besteht im Abbau des Blutdruck-steigernden Hormons Angiotensin I. Wenn SARS-CoV-2 mit seinem Spike-Protein an ACE2 bindet, kann dieser Abbau nicht erfolgen, und es kommt zu einem Überschuss an Angiotensin II. Das könnte erklären, warum insbesondere Patienten mit Herz-Kreislauf-Erkrankungen, Diabetes und Bluthochdruck oft schwer an COVID-19 erkranken. In großer Rezeptordichte kommt ACE2 auch auf Darmepithelzellen vor; ob diese aber auch ein Tor für die Infektion mit dem Virus darstellen, ist noch nicht geklärt.
Zusätzlich benötigt das Virus zum Eindringen in die Zelle den Kofaktor TMPRSS2, ein Enzym, das mit dem ACE2-Rezeptor einen Komplex bildet. Für das SARS-Virus von 2003 hatte man schon gezeigt, dass erst die Aktivierung des Spike-Proteins durch TMPRSS2 eine Fusion der Virushülle mit der Zellmembran möglich macht. Im Rahmen des Deutschen Zentrums für Lungenforschung haben jetzt Prof. Roland Eils (vormals Universität Heidelberg, jetzt Berlin Institute of Health) und seine Kollegen von der Thoraxklinik Heidelberg und der Berliner Charité mithilfe einer „Single Cell-Sequenziertechnik“ an 60.000 einzelnen Zellen nachgewiesen, dass vor allem bestimmte Vorläuferzellen in den Bronchien den ACE2-Rezeptor und den TMPRSS2-Kofaktor exprimieren. Diese Vorläuferzellen entwickeln sich normalerweise weiter zu den Flimmerhärchen-Epithelzellen, die Schleim und Bakterien aus der Lunge heraustransportieren. Die Wissenschaftler beobachteten, dass die Dichte an ACE2-Rezeptoren auf den Zellen mit dem Alter anstieg und bei Männern höher lag als bei Frauen, was damit zusammenhängen könnte, dass COVID-19 stärker bei alten Personen und generell häufiger bei Männern auftritt. Wie Eils jedoch betont, „war das nur ein Trend, und für belegbare Aussagen sind unsere Fallzahlen zu gering.“ Die Untersuchungen zeigen aber, dass SARS-CoV-2 für seine Vermehrung und Verbreitung auf bestimmte Körperzellen angewiesen ist. Solche Analysen der Zusammenhänge zwischen dem Virus mit seinem Spike-Protein und den menschlichen Zellen mit Rezeptoren und Kofaktoren tragen dazu bei, die Krankheitsverläufe von COVID-19-Patienten zu verstehen und Hochrisikopatienten zu identifizieren.
Ein rekombinantes SARS-CoV-2-Spike-Protein
Die Trenzyme GmbH in Konstanz hat für die Erforschung des Coronavirus und seiner Bindung an die menschlichen Zellen ein rekombinantes Protein mit der Rezeptor-Bindungsdomäne (RBD) des Spike-Proteins von SARS-CoV-2 hergestellt; an seinem C-Terminus ist als Markierung ein Histidin-Tag angebracht. Auch dieses rekombinante Protein, das beispielsweise für die Entwicklung von Impfstoffen, aber auch als Antigen oder Kontrollprotein für analytische oder diagnostische Untersuchungen verwendet werden kann, basiert auf der Entschlüsselung und Veröffentlichung der Genomsequenz des Wuhan-Virus vom Januar 2020. Trenzyme hat sich in den zwanzig Jahren seit seiner Gründung durch den Konstanzer Biochemiker Dr. Reinhold Horlacher einen Namen als Auftragsforschungsunternehmen für die pharmazeutische Industrie und akademische Forschung gemacht, das rekombinante Proteine in hervorragend exprimierenden Zelllinien unter strengsten Qualitätskriterien produziert und reinigt. Das rekombinante Protein mit der RBD des Spike-Proteins von SARS-CoV-2 könnte eingesetzt werden, um Substanzen zu finden, mit denen der Rezeptor und der Viruseintritt in die Zelle blockiert wird und Strategien für wirksame Therapien entwickelt werden können. Wie Horlacher schreibt, ist er als CEO stolz darauf, dass Trenzyme mit seinen Produkten auch dazu beitragen kann, die Entwicklung innovativer Wirkstoffe zur Eindämmung und Überwindung der COVID-19-Pandemie voranzutreiben.