Nanopartikel als Wirkstoffträger
Inhalationen von Antibiotika-Nanocarriern gegen resistente Tuberkulose-Erreger
Noch immer erkranken weltweit rund zehn Mio. Menschen pro Jahr an Tuberkulose. Bis COVID-19 war Tuberkulose mit 1,4 Mio. Toten jährlich die tödlichste Infektionskrankheit. Das Problem liegt in der raffinierten Biologie des Erregers Mycobacterium tuberculosis. Ein Forschendenteam des KIT in Karlsruhe und dem Forschungszentrum Borstel, Leibniz Lungenzentrum (FZB), haben im Rahmen des vom BMBF geförderten Verbundprojekts „ANTI-TB“ eine Methode realisiert, um das Bakterium doch noch auszutricksen. Dafür entwickelte Prof. Dr. Claus Feldmann am KIT Nanopartikel, deren Wirksamkeit gegen den Tuberkuloseerreger von Prof. Dr. Ulrich Schaible am FZB als Aerosol erfolgreich getestet wurde.
1882 wurde der „Tuberkelbazillus“ erstmals entdeckt und beschrieben. Robert Koch erhielt dafür 1905 den Medizin-Nobelpreis. Um der Krankheit Herr zu werden, liegt der Fokus heute vor allem auf der aktiven Behandlung mit Antibiotika. Ein Impfstoff wird seit 1998 nicht mehr von der STIKO empfohlen, da er gegen Lungentuberkulose bei Erwachsenen nicht ausreichend wirkt.
Insgesamt wird eine besorgniserregende Zunahme der Tuberkulosefälle durch antibiotikaresistente Erreger verzeichnet, insbesondere durch Armut und Mangel im Gesundheitswesen in ärmeren Ländern. Aber auch in Deutschland werden drei Prozent der insgesamt 4.000 Fälle dieser meldepflichtigen Erkrankung pro Jahr als multiresistent registriert. Durch die COVID-Pandemie sind bisherige Fortschritte in der Bekämpfung verlangsamt oder sogar rückgängig gemacht worden.
Krankheit meist unerkannt
„Man geht davon aus, dass etwa ein Viertel der Weltbevölkerung mit Tuberkulose infiziert ist“, sagt der Chemiker Prof. Dr. Claus Feldmann, der am KIT an Nanopartikeln forscht. „Sie ist sehr infektiös: wenn es eine Person hat, dann können Kontaktpersonen auch infiziert werden.“ Die Tuberkulose kann in vielen Organen auftreten, am häufigsten ist mit 90 Prozent die Lunge betroffen. Die Ansteckung erfolgt meist über ein Einatmen bakterienhaltiger Aerosole, die von Infizierten ausgehustet werden. Nur fünf bis zehn Prozent der Infizierten erkranken jedoch tatsächlich im Lauf des Lebens, beim Rest bleibt die Tuberkulose meist klinisch unauffällig (latent) und ist auch nicht ansteckend.
Die Erreger werden vom Immunsystem oft schon in den Atemwegen abgewehrt. Werden sie allerdings nicht erkannt, können sie sich in der Lunge festsetzen, wo sie sich abkapseln und jahrelang ohne Symptome im Körper verbleiben. Eine Reaktivierung der latenten Infektion bewirkt, dass die Erreger sich wieder massiv vermehren und die überbordende Entzündungsreaktion Granulome aufbrechen lässt. Dadurch entsteht eine offene Tuberkulose. Es kommt zu Müdigkeit, Fieber und Husten. In schweren Fällen wird Lungengewebe zerstört, welches mit blutigem Auswurf abgehustet wird und zu Löchern in der Lunge führt. Der Körper steckt nun all seine Energie in die Infektionsbekämpfung. Der damals von Hippokrates geprägte Begriff „Schwindsucht“ trifft es ziemlich gut: Der oder die Kranke wird zunehmend schwächer, und bleibt die Tuberkulose unbehandelt, kann sie zum Tod führen.
Cleveres Mykobakterium
 Prof. Dr. Claus Feldmann entwickelt am Karlsruher Institut für Technologie (KIT) mit den Nanocarriern kleinste Transportcontainer, die Antibiotika zu den Bakterien bringen. © Prof. Dr. Claus Feldmann, privat
Prof. Dr. Claus Feldmann entwickelt am Karlsruher Institut für Technologie (KIT) mit den Nanocarriern kleinste Transportcontainer, die Antibiotika zu den Bakterien bringen. © Prof. Dr. Claus Feldmann, privatDie übliche Therapie besteht in den ersten zwei Monaten aus einer Kombination von vier verschiedenen Antibiotika, die anschließenden vier Monate noch aus zwei dieser Antibiotika. Schwierigkeiten machen resistente Erregerstämme, die immer häufiger auftreten, wenn Behandlungen zu früh abgebrochen werden. Daher gibt die WHO vor, die Therapie noch mindestens ein halbes Jahr über die Beschwerden hinaus fortzusetzen. Das Problem: die oral verabreichten Medikamente können Nebenwirkungen wie Gehör-, Leber- und Nierenschäden verursachen und die Akzeptanz der Einnahme verringern, zudem sich die Patientinnen und Patienten besser fühlen. „Die Gefahr ist groß, dass einige der Bakterien dann noch nicht abgetötet sind und eine Resistenz entwickeln, weil die Wirkstoffkonzentration am Ort nicht mehr hoch genug ist“, erklärt Feldmann. Eine Behandlung kann durchaus bis zu zwei Jahre dauern.
Außerdem hat der stäbchenförmige Erreger Mycobacterium tuberculosis clevere Strategien, um dem Immunsystem zu entkommen. In der Regel nehmen Fresszellen Eindringlinge in der Lunge durch Phagozytose auf und eliminieren sie. Das Mykobakterium, das sich in einem Phagosom befindet, stört durch Glykolipide in der bakteriellen Zellwand die Verdauung der Fresszelle und sichert so sein eigenes Überleben innerhalb der Zelle. Das Immunsystem reagiert darauf mit der Bildung eines Walls aus verschiedenen Abwehrzellen um den Entzündungsherd herum. Das führt lokal zu einem Gewebsuntergang (Nekrose) und zur Entstehung eines tuberkulösen Granuloms, was den Erreger an Ort und Stelle isoliert und die Weiterverbreitung verhindert. Als Reaktion auf die Abkapselung stellen die Mykobakterien ihren Stoffwechsel um und nutzen als Kohlenstoffquelle nun Fette aus dem abgestorbenen Gewebe. Der Erreger kann auch vorübergehend seinen Stoffwechsel ganz einstellen und im Zustand der Dormanz ausharren. Das ohnehin schon extrem langsame Wachstum wird nochmals verlangsamt oder gestoppt.
Wirkstoffträger auf Nanobasis
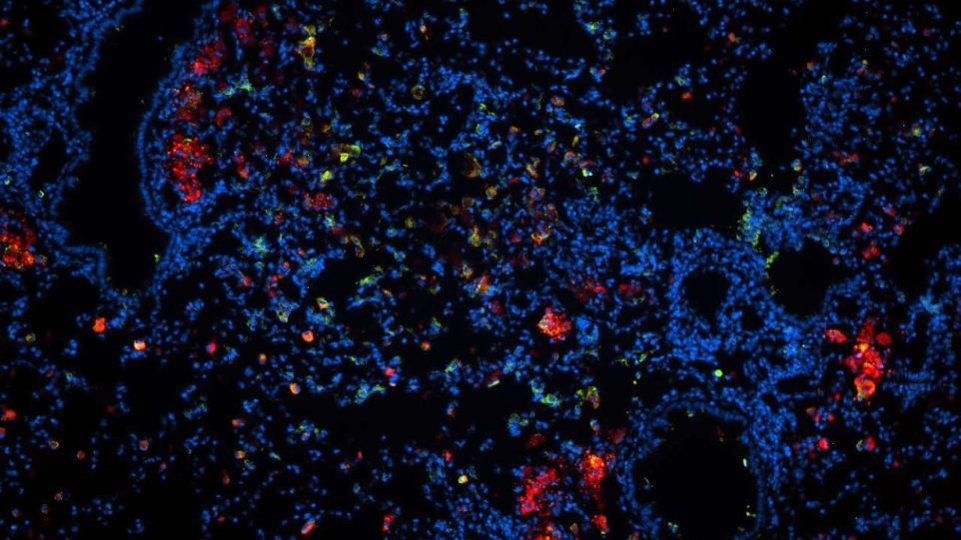 Infiziertes Lungengewebe mit Zellkernen (blau) und Mycobacterium tuberculosis (grün), in dem die Antibiotika-Nanocarrier (rot) am Ort der Infektion angekommen sind. © Dr. Natalja Redinger, Forschungszentrum Borstel, Leibniz Lungenzentrum (FZB)
Infiziertes Lungengewebe mit Zellkernen (blau) und Mycobacterium tuberculosis (grün), in dem die Antibiotika-Nanocarrier (rot) am Ort der Infektion angekommen sind. © Dr. Natalja Redinger, Forschungszentrum Borstel, Leibniz Lungenzentrum (FZB)Antibiotika, die in Zellprozesse eingreifen, sind hier unwirksam. Eine erhöhte Mutationsrate auch während der Dormanz macht die Jagd auf den Erreger noch schwerer, da schon eine Mutation an der entscheidenden Stelle im Enzym reicht, um den Angriffspunkt für Medikamente zu beseitigen. Das Mykobakterium hat zudem noch die Möglichkeit, Stoffe mit Hilfe einer Effluxpumpe selektiv aus der Zelle heraus zu transportieren. Damit verlieren die meisten Antibiotika ihren Effekt. Neben den multiresistenten (gegen mindestens zwei gängige Antibiotika) haben die extrem resistenten Bakterien zusätzlich noch eine Toleranz gegenüber Fluorchinolon. Letztere machen etwa zehn Prozent der Resistenzen weltweit aus.
„Man muss neben neuen Wirkstoffen auch neue Verabreichungsmethoden finden, weil der Wirkstoff am Infektionsort in ausreichend hoher Konzentration vorliegen muss“, sagt Feldmann. Problematisch: die meisten Antibiotika sind lipophil, lassen sich also in wässrigen Milieus wie der Lungenoberfläche nicht transportieren. Feldmann und sein Team stellten Antibiotika-beladene Nanocontainer her, die effektiv an den Zielort gebracht werden können. Die Idee ist, die Konzentration lokal so zu steigern, um die Therapiedauer zu verkürzen und Nebenwirkungen zu mindern. Die Bereitschaft der Patientinnen und Patienten könnte somit erhöht werden, die Therapie durchzuhalten. „Unser Ansatz war, sehr kleine Partikel als Aerosol quasi direkt über die Lunge aufzunehmen, da es sich in erster Linie um eine Lungenerkrankung handelt“, erklärt der Chemiker. „Das Besondere ist die geringe Größe von 30 Nanometern sowie die Tatsache, dass diese kleine Kugel fast ausschließlich aus Antibiotikum besteht.“ Zwei neue Antibiotika werden hochdosiert in die Nanocarrier gepackt: Bedaquilin (BDQ) hemmt die ATPase in sich teilenden und sich nicht-teilenden Bakterien. Benzothiazin (BDZ-043) hemmt ein Enzym, das zum Aufbau der Zellwand benötigt wird und die Auflösung der Zelle bewirkt.
Verabreichung wie Asthmaspray
 Verantwortlich für die medizinische Seite des Projekts und das Testen der Machbarkeit in lebenden Systemen: Prof. Dr. Ulrich Schaible am Forschungszentrum Borstel, Leibniz Lungenzentrum (FZB). © Prof. Dr. Ulrich E. Schaible, privat
Verantwortlich für die medizinische Seite des Projekts und das Testen der Machbarkeit in lebenden Systemen: Prof. Dr. Ulrich Schaible am Forschungszentrum Borstel, Leibniz Lungenzentrum (FZB). © Prof. Dr. Ulrich E. Schaible, privatAuch diese Wirkstoffe sind jedoch fettlöslich und müssen für den Transport dispergiert werden. Nach der Synthese liegt BDQ zu 70 Prozent und BTZ-043 sogar zu 99 Prozent im Nanocarrier vor. Der Rest wird durch Tenside gestellt, um die Antibiotika im wässrigen Milieu einnehmen zu können. Der chemische Trick: Die fettlösliche Antibiotikalösung wird sehr schnell in Wasser mit einem Tensid eingespritzt, sodass der Wirkstoff plötzlich als Feststoff ausfällt und sich mit dem Tensid verbindet. „So bekommt man Nanopartikel und kann sie auch über mehrere Wochen stabilisieren“, so Feldmann.
Am Forschungszentrum Borstel konnte gezeigt werden, dass die infizierten Zellen die Nanocarrier sehr gut aufnehmen und der Wirkstoff auch tatsächlich bei den Bakterien ankommt. Prof. Dr. Ulrich Schaible, der dort an der Wirts-Erreger-Interaktion in der Tuberkulose forscht und die Bioverteilung und Effizienz in tuberkuloseinfizierten Mäusen getestet hat, wurde durch die Ergebnisse überzeugt, dass die Antibiotika-Nanopartikel hochdosiert an die Tuberkuloseherde in die Lunge gebracht werden und sie dort gegen intrazelluläre Mykobakterien wirken. Die Studien in infizierten Mäusen zeigten eine bis zu 50 Prozent höhere Wirksamkeit als herkömmliche pulmonale Inhalationen. Durch die direkte Gabe in die Lunge können Nebenwirkungen minimiert werden, und es ist mit weniger Resistenzen zu rechnen. In einem Carrier können wahrscheinlich zwei Antibiotika mit unterschiedlichem Wirkprinzip vereint und als Flüssig- oder Trockenaerosol per Spray inhaliert werden. Dennoch dauert es mindestens noch fünf Jahre mit weiteren Studien, bis diese vielversprechende Therapie im Klinikalltag angekommen ist.