RHEACELL GmbH
Innovative Stammzelltherapie für chronische Wunden
Nichtheilende, chronisch entzündete Wunden können sehr schmerzhaft sein und bergen das Risiko schwerwiegender Infektionen. Basierend auf ABCB5-positiven mesenchymalen Stammzellen hat das Heidelberger Unternehmen RHEACELL ein einzigartiges Arzneimittel entwickelt, das die Umprogrammierung der verantwortlichen Immunzellen fördert und so ein Abheilen ermöglicht.
Mehr als eine Million Menschen in Deutschland leiden unter chronischen Wunden, also Verletzungen der Haut, die auch nach acht Wochen noch nicht abgeheilt sind.1) In den meisten Fällen liegt die Ursache in einer Grunderkrankung, die die Gewebeempfindlichkeit erhöht und den Heilungsverlauf behindert. Durchblutungsstörungen aufgrund verengter Arterien beispielsweise, verringern die Versorgung mit Sauerstoff und Nährstoffen. Chronisch venöse Wunden (CVUs von Chronisch Venöse Ulzera) wiederum basieren auf einer Schwäche der Venenklappen, wodurch sich das Blut in den unteren Venen staut und Erythrozyten ins Gewebe gedrückt werden. Das aus dem roten Blutfarbstoff freigesetzte Eisen verursacht dann Entzündungen. Der diabetische Fuß hingegen entsteht, wenn bei Diabetes mellitus langfristig erhöhte Blutzuckerspiegel die Gefäße und Nerven schädigen und die Blutzirkulation einschränken. Auch ein geschwächtes Immunsystem kann den Heilungsverlauf verzögern. „Die nichtheilende Wunde ist gefangen in einer chronischen Entzündung“, erläutert Dr. Christoph Ganss, Gründer und CEO der RHEACELL GmbH & Co. KG. Ein neuartiges Zelltherapeutikum des Heidelberger Unternehmens hat das Potenzial, diesen Kreislauf zu durchbrechen und die physiologische Funktion des Gewebes wiederherzustellen.
ABCB5-positive Stammzellen induzieren entzündungshemmende Makrophagen
Entzündungen sind die natürlichen Reaktionen des Immunsystems auf schädigende Reize. Eine wichtige Rolle in diesem Prozess spielen Makrophagen, spezielle Fresszellen, die neben Fremdstoffen und Krankheitserregern auch geschädigtes Gewebe beseitigen. Nach einer Verletzung wandern M1-Makrophagen an die betroffene Stelle und schütten zusätzlich entzündungsfördernde Botenstoffe wie Interleukin-1β (IL-1β) und Tumornekrosefaktor-α (TNF-α) aus, die weitere Immunzellen anlocken und aktivieren. Diese erste Phase der Wundheilung dient der Reinigung und kann bis zu drei Tage dauern. Während der anschließenden Proliferationsphase entsteht zunächst sogenanntes Granulationsgewebe, das die Wunde provisorisch abdeckt, und das in der nachfolgenden Epithelisierungsphase in widerstandsfähiges Narbengewebe umgebaut wird. Bei normalem Heilungsverlauf schließt sich eine akute Wunde innerhalb von drei Wochen.
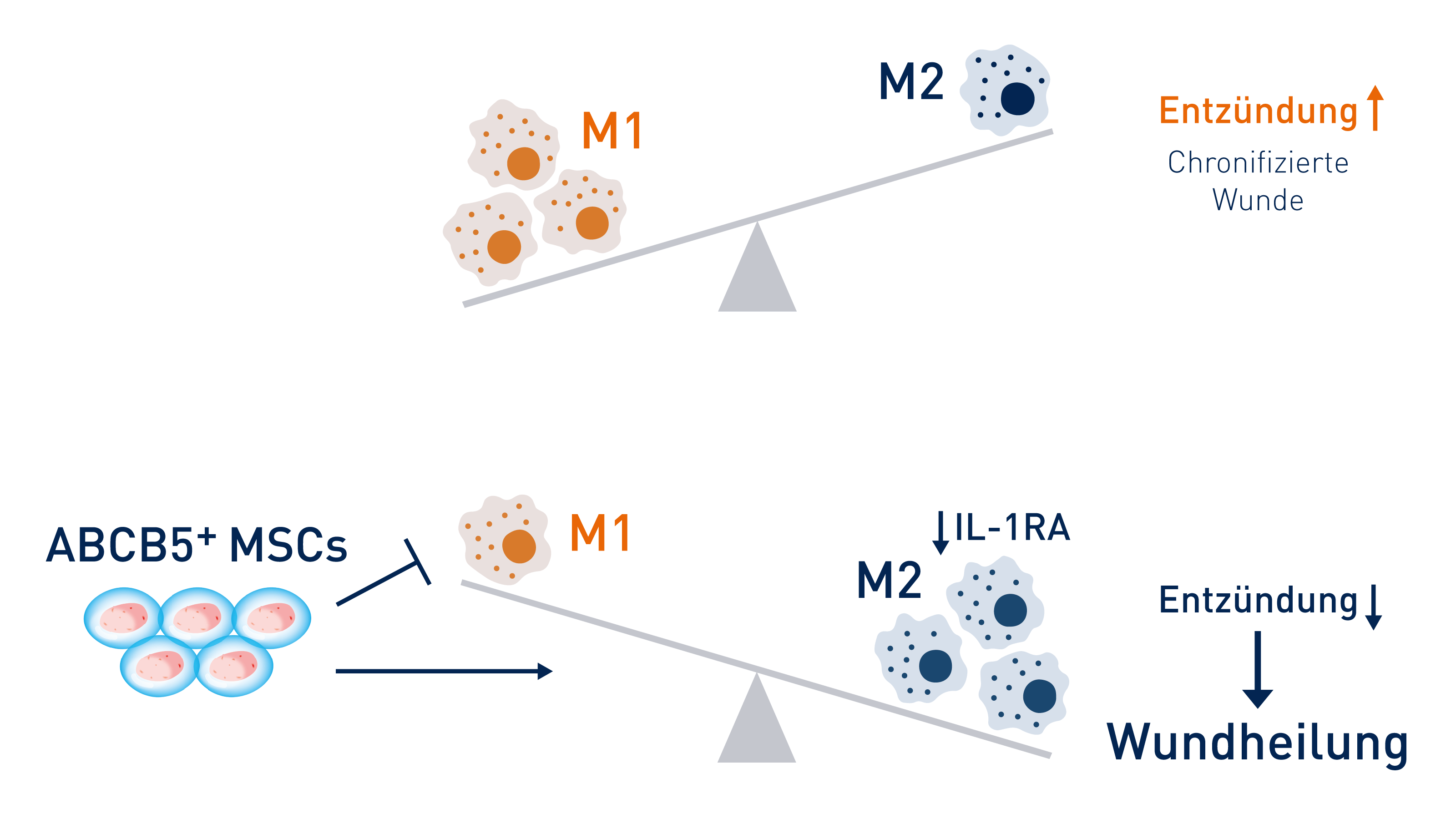 Chronische Wunden enthalten vor allem entzündungsfördernde M1-Makrophagen, die in einem sich selbst stimulierenden Kreislauf gefangen sind. Durch die Ausschüttung von IL-1RA verschieben ABCB5+-Stammzellen das Gleichgewicht zu heilungsfördernden M2-Makrophagen. © RHEACELL GmbH & Co. KG
Chronische Wunden enthalten vor allem entzündungsfördernde M1-Makrophagen, die in einem sich selbst stimulierenden Kreislauf gefangen sind. Durch die Ausschüttung von IL-1RA verschieben ABCB5+-Stammzellen das Gleichgewicht zu heilungsfördernden M2-Makrophagen. © RHEACELL GmbH & Co. KGNicht nur andere Immunzellen, sondern auch Makrophagen besitzen einen Rezeptor für IL-1β auf ihrer Oberfläche, sodass aktive M1-Makrophagen sich selbst stimulieren. Für den Austritt aus der Entzündungsphase muss dieser Kreislauf unterbrochen werden, damit die Umwandlung der entzündungsfördernden M1-Makrophagen in entzündungshemmende M2-Makrophagen stattfinden kann. Hierbei spielt der Interleukin-1-Rezeptor-Antagonist (IL-1RA) eine wichtige Rolle, der die Wirkung des Botenstoffes IL-1β blockiert, indem er dessen Bindung an den IL-1-Rezeptor verhindert. Sind die körpereigenen Mengen an IL-1RA zu gering, stagniert die Wunde in einer chronischen Entzündung.
An diesem Punkt setzt RHEACELL mit seinem Zelltherapeutikum auf Basis von ABCB5-positiven mesenchymalen Stammzellen (ABCB5+ MSCs) an. Mesenchymale Stammzellen sind multipotente Vorläuferzellen des Binde- und Stützgewebes, die sich beispielsweise zu Knochen-, Knorpel-, Fett- und Muskelzellen entwickeln können. Eine besondere Subpopulation trägt auf ihrer Oberfläche das Regulatorprotein ABCB5 (ATP Binding Cassette Subfamily-B Member 5) und besitzt einzigartige immunmodulatorische Eigenschaften, zu denen unter anderem die Ausschüttung von IL-1RA zählt. „Die Blockade von IL-1β ist ein zentraler anti-inflammatorischer Mechanismus, der den Switch von M1- zu M2-Makrophagen bewirkt. Aus der chronischen Wunde wird so eine akute Wunde, die abheilen kann“, führt Ganss aus. „Nach Verabreichung der ABCB5-positiven Stammzellen in eine Wunde nisten sich diese im Gewebe ein, treten mit den umgebenden Immunzellen in Wechselwirkung und bewirken so eine Umprogrammierung. Die alleinige Gabe des Antagonisten hat diese Wirkung nicht.“ Die M2-Makrophagen sezernieren unter anderem entzündungshemmendes Interleukin-10 sowie vaskuläre endotheliale Wachstumsfaktoren (VEGF, Vascular Endothelial Growth Factor), die die Bildung neuer Blutgefäße anregen.
Patentierter Herstellungsprozess
 Dr. Christoph Ganss entwickelt mit seinen Unternehmen RHEACELL und TICEBA innovative Stammzelltherapeutika. © RHEACELL GmbH & Co. KG
Dr. Christoph Ganss entwickelt mit seinen Unternehmen RHEACELL und TICEBA innovative Stammzelltherapeutika. © RHEACELL GmbH & Co. KGGewonnen werden die ABCB5+ MSCs aus Spenderhaut, in der sie einen Anteil von zwei bis drei Prozent ausmachen. Die Isolierung und Vermehrung wird mithilfe eines aufwändigen, patentierten Verfahrens von der TICEBA GmbH durchgeführt und liefert ein hochreines Produkt, das zu mehr als 90 Prozent aus ABCB5-positiven Zellen besteht. Das bereits 2003 von Ganss als Stammzellbank gegründete Unternehmen übernimmt die komplette Herstellung und Qualitätskontrolle sowie alle Untersuchungen zur Wirksamkeit des zur Klasse der Arzneimittel für neuartige Therapien (Advanced Therapy Medicinal Products, ATMP) zählenden Therapeutikums. TICEBA ist weltweit der einzige Lizenznehmer für Produkte um das ABCB5-Molekül, das zu Beginn des Jahrtausends erstmals von Prof. Dr. Markus Frank vom Harvard Stem Cell Institute beschrieben wurde. Die 2012 als Joint Venture zwischen TICEBA und der Müller Holding gegründete RHEACELL GmbH ist für die Durchführung der Klinischen Studien zuständig.
Bisherige Daten zeigen, dass ABCB5+ MSCs bei der Behandlung von CVUs große Erfolge erzielen können.2) Die lokal verabreichten Stammzellen sind gut verträglich und bewirken bei drei von vier Behandelten eine Wundgrößenreduktion von mehr als 80 Prozent innerhalb von zwölf Wochen. Damit Betroffene bereits vor der allgemeinen Zulassung von dem Präparat profitieren können, erhielt RHEACELL im Oktober 2021 für sein Zelltherapeutikum AMESANAR® eine nationale Marktgenehmigung vom Paul-Ehrlich-Institut. Dies erlaubt es definierten Facharztgruppen, das Produkt schon jetzt bei CVU-Patientinnen und -Patienten anzuwenden. Auch Personen mit diabetischen Fußwunden profitieren stark von den ABCB5+ MSCs, wie laufende Studien belegen.
Effektiv auch bei genetisch bedingten Erkrankungen
Neben der Anwendung bei chronischen Wunden untersucht RHEACELL auch die Wirkung der Stammzellen bei angeborenen und derzeit nicht heilbaren, schweren Hauterkrankungen wie der rezessiven dystrophischen Epidermolysis bullosa (RDEB). Diese wird auch als Schmetterlingskrankheit bezeichnet, da die Haut der Betroffenen so verletzlich ist wie die Flügel eines Schmetterlings. Aufgrund eines genetischen Defekts im Strukturprotein Kollagen VII kann es überall am Körper, inklusive innerer Schleimhäute, zur Bläschenbildung und daraus resultierenden offenen Wunden kommen. Da es bisher keine heilende Therapie gibt, ruhen große Hoffnungen auf der im Sommer 2022 in Europa und den USA startenden Zulassungsstudie von RHEACELL.
Bei RDEB handelt es sich um eine systemische Erkrankung. Deshalb werden die Zellen hier nicht in die Wunden appliziert, sondern als Infusion verabreicht. In Zusammenarbeit mit renommierten internationalen Arbeitsgruppen konnte im Mausmodell bereits gezeigt werden, dass sich die ABCB5+ MSCs in den Wunden einnisten (Homing) und neben IL-1RA auch Kollagen VII sowie die Strukturproteine Laminin und Keratin 14 produzieren. Letztere werden in der Wunde eingelagert und ermöglichen so die Heilung. „Unsere Zellen haben ein großes Homingpotenzial und sind deshalb das ideale Arzneimittel“, beschreibt Ganss die Situation. „Es gibt keinerlei Abstoßungsreaktionen, da die MSCs immunprivilegiert sind und nicht als fremd erkannt werden. Aus diesem Grund haben wir uns früh entschieden, mit allogenen - also körperfremden - Zellen zu arbeiten.“ Diese können im Voraus hergestellt und eingefroren werden, sodass sie bei Bedarf schnell verfügbar sind. Abhängig von der Wundgröße erhält dann jeder und jede Betroffene ein individuell angepasstes Medikament.
In Zukunft will RHEACELL das Anwendungsgebiet der ABCB5+ MSCs auf weitere Erkrankungen ausweiten, die ebenfalls auf einer fehlgeleiteten Entzündungsreaktion des Immunsystems beruhen, wie beispielsweise die akute Graft-versus-Host-Erkrankung.