Biosensor für Vollblut- und Atemgasanalyse
Antibiotika-Nachweis aus Vollblut oder Atemgas möglich
Falsch dosierte Antibiotika sind nicht nur gefährlich für Patientinnen und Patienten, sondern häufig auch die Ursache für resistente Bakterienstämme. Um die wirksame Menge zu bestimmen und so eine Personalisierte Therapie zu ermöglichen, haben Forschende der Universität Freiburg einen Biosensor entwickelt, der in kurzer Zeit kleinste Mengen der Substanzen direkt aus Vollblut oder Atemgas bestimmen kann.
Bei bakteriellen Infektionen sind Antibiotika das Mittel der Wahl. Sie verhindern die Vermehrung der Erreger oder töten diese sogar ab. Natürlich vorkommende Antibiotika werden von Schimmelpilzen, aber auch von Bakterien gebildet. „Leben verhindert Leben“, stellte 1877 bereits Louis Pasteur fest und beschrieb damit den Effekt, dass sich verschiedene Bakterienarten gegenseitig am Wachstum hindern. Kurz darauf (1893) gelang es dem italienischen Arzt Bartolomeo Gosio, aus einem Pilz der Gattung Penicillium einen Stoff zu isolieren, der die Vermehrung von Milzbranderregern aufhalten konnte. Diese Untersuchungen wurden allerdings international kaum beachtet, sodass heute Alexander Fleming offiziell als Entdecker des Antibiotikums Penicillin gilt. Er beobachtete zufällig, dass das Wachstum von Staphylokokken auf Kulturplatten durch eine Schimmelpilzkontamination gehemmt wird. Für seine nachfolgenden Arbeiten zum Verständnis der Wirkung von Penicillin und für die Entwicklung therapeutisch wirksamer Derivate erhielt er 1945 den Nobelpreis für Medizin.
Penicilline wirken vor allem gegen Bakterien, deren Zellmembran von einer dicken Schicht aus Murein, einem vernetzten Makromolekül aus Aminosäuren und Zucker (Peptidoglykan), überzogen ist. Zu diesen sogenannten gram-positiven Erregern – sie erscheinen blau nach der Gram-Färbung – zählen unter anderem Staphylococcus aureus (häufiger Verursacher von Sepsis) und Pneumokokken (Verursacher von Lungenentzündung) sowie Milzbrand- und Diphterie-Erreger. Die Antibiotika hemmen eine Gruppe bakterieller Enzyme, die für die Murein-Synthese essenziell sind, sogenannte Penicillin-bindende Proteine (PBP). Dadurch wird die neusynthetisierte Zellwand instabil, und die Bakterien platzen letztendlich durch das Eindringen von Wasser. Penicilline töten also nur Zellen, die wachsen und sich teilen.
Unkontrollierter Einsatz erzeugt Resistenzen
 Dr. Can Dincer entwickelte zusammen mit seinen Mitarbeiterinnen H. Ceren Ates und Regina T. Glatz einen Biosensor, der kleinste Mengen an Antibiotika in verschiedenen Körperflüssigkeiten detektieren kann. © Patrick Seeger/Universität Freiburg
Dr. Can Dincer entwickelte zusammen mit seinen Mitarbeiterinnen H. Ceren Ates und Regina T. Glatz einen Biosensor, der kleinste Mengen an Antibiotika in verschiedenen Körperflüssigkeiten detektieren kann. © Patrick Seeger/Universität FreiburgBereits im 2. Weltkrieg kamen Penicillin-Derivate auf den Schlachtfeldern zum Einsatz und retteten vielen Soldaten das Leben. Sie galten lange Zeit als Wunderheilmittel und wurden ohne große Einschränkungen verwendet; nicht nur beim Menschen, sondern später auch in der Massentierhaltung. Vor allem diese flächendeckende Nutzung, aber auch eine zu niedrige Dosierung oder zu kurze Einnahmezeiten führten dazu, dass Bakterien Resistenzen entwickelten. In Deutschland sterben deshalb jedes Jahr mehrere Tausend Menschen durch multiresistente Erreger. „Wir benötigen eine Personalisierte Antibiotika-Therapie, die neben Beginn und Ende der Einnahme vor allem die Dosis genau definiert. Die wirksame Menge im Blut muss hoch genug sein, um Resistenzen zu vermeiden, darf aber nicht zu Organschädigungen führen“, erklärt Dr. Can Dincer vom Freiburger Zentrum für interaktive Werkstoffe und bioinspirierte Technologien der Universität Freiburg (FIT) und Leiter der Arbeitsgruppe Disposable Microsystems am Institut für Mikrosystemtechnik (IMTEK).
Biosensor zum schnellen Nachweis der Penicillin-Konzentration
Zu diesem Zweck entwickelte er im Rahmen eines DFG-Förderprojektes zusammen mit den Arbeitsgruppen Synthetische Biologie von Prof. Dr. Wilfried Weber (CIBSS – Center for Integrative Biological Signalling Studies der Universität Freiburg) und Klinische Atemphysiologie von Prof. Dr. Stefan Schumann (Klinik für Anästhesiologie und Intensivmedizin des Universitätsklinikums Freiburg) einen speziellen Biosensor, der geringste Mengen an Penicillinen detektieren kann.1) Der erste Bereich des Sensors ist mit einem synthetisch hergestellten PBP beschichtet, das die Grundstruktur der Penicilline, den ß-Lactam-Ring, erkennt. Hier verdrängt das in der Probe enthaltene Antibiotikum ein spezielles ß-Lactam-Molekül aus der Bindung, das mit dem Enzym Glucose-Oxidase verknüpft ist. Dieses generiert nach Zugabe von Glucose die Substanz Wasserstoffperoxid (H2O2). In einer nachgeschalteten elektrochemischen Zelle wird die Menge des entstandenen H2O2 dann amperometrisch als Stromfluss nachgewiesen. Die Stromabnahme dient dabei als Maß für die Menge des Penicillins in der Probe. Vergleichsmessungen mithilfe des aufwendigen HPLC-Verfahrens (High Performance Liquid Chromatography) an der Uniklinik Freiburg bestätigten die Genauigkeit der neuen Technik. Mit ihr lassen sich in weniger als 90 min. Antibiotika-Konzentrationen im Größenbereich von ng/ml detektieren. Damit ist sie bis zu 500-mal sensitiver als gebräuchliche Nachweismethoden.
Bestimmung aus Vollblut oder Atemgas
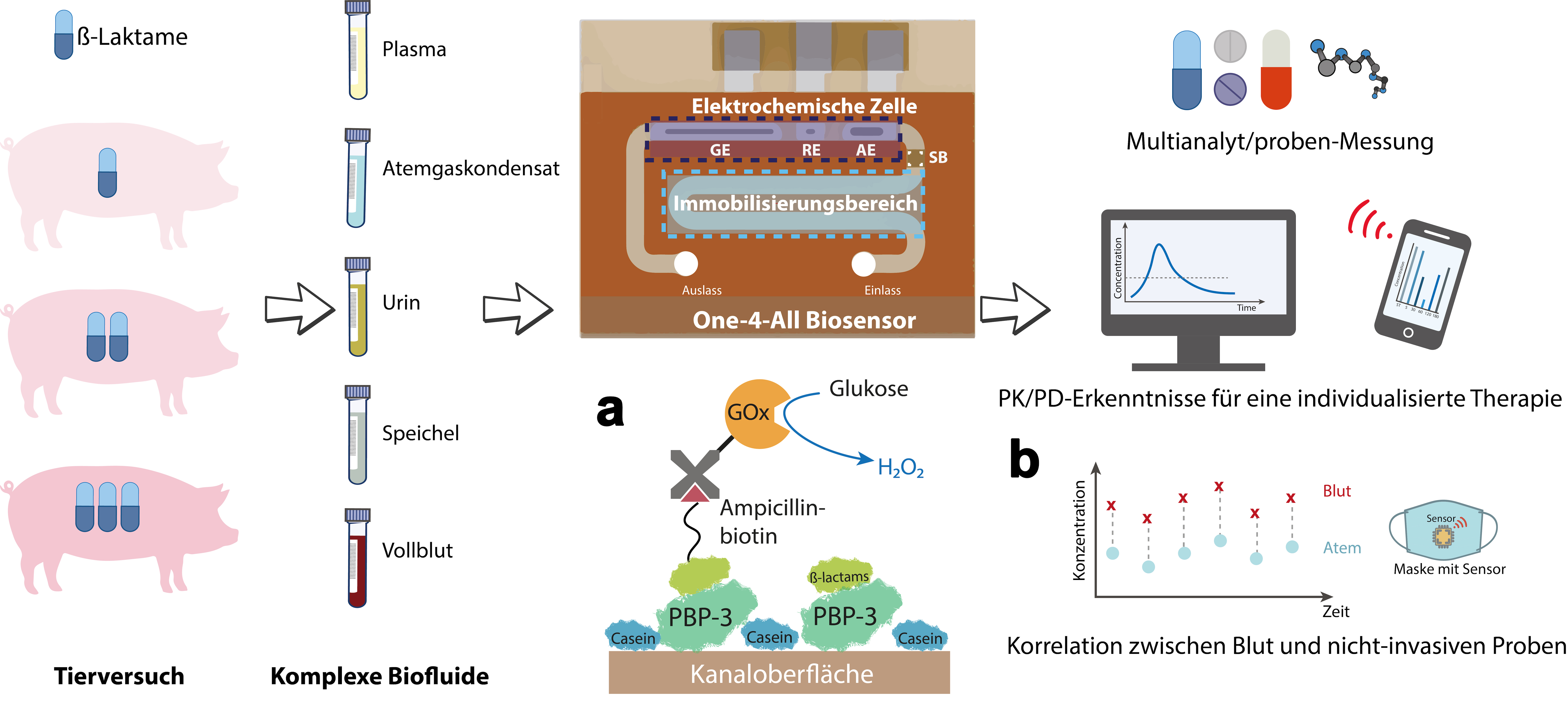 Verschiedene Körperflüssigkeiten von Schweinen, die unterschiedliche Antibiotika-Mengen erhalten hatten, wurden mithilfe des neuartigen Biosensors analysiert. a Die Sensoroberfläche ist mit einem Penicillin-bindenden Protein (PBP) beschichtet, das entweder ein ß-Lactam-Antibiotikum oder das mit Glucose-Oxidase (GOx) verknüpfte Ampicillin binden kann. GOx generiert bei Vorhandensein von Glucose Wasserstoffperoxid (H2O2), dessen Menge als Stromfluss messbar ist. b Die in Atemgaskondensat gemessene Antibiotika-Konzentration korreliert direkt mit dem im Blut vorhandenen Pegel, so dass langfristig eine sensorintegrierte Gesichtsmaske denkbar ist.
Verschiedene Körperflüssigkeiten von Schweinen, die unterschiedliche Antibiotika-Mengen erhalten hatten, wurden mithilfe des neuartigen Biosensors analysiert. a Die Sensoroberfläche ist mit einem Penicillin-bindenden Protein (PBP) beschichtet, das entweder ein ß-Lactam-Antibiotikum oder das mit Glucose-Oxidase (GOx) verknüpfte Ampicillin binden kann. GOx generiert bei Vorhandensein von Glucose Wasserstoffperoxid (H2O2), dessen Menge als Stromfluss messbar ist. b Die in Atemgaskondensat gemessene Antibiotika-Konzentration korreliert direkt mit dem im Blut vorhandenen Pegel, so dass langfristig eine sensorintegrierte Gesichtsmaske denkbar ist.
Quelle: C. Dincer, https://doi.org/10.1002/adma.202104555, CC-BY 4.0, übersetzt von C. Dincer„Ein echtes Highlight ist die Möglichkeit der Analyse von Vollblut, vergleichbar der Blutzuckerbestimmung mit Teststreifen bei Diabetikern“, beschreibt Dincer eine Besonderheit des Biosensors. „Dies erlaubt eine unkomplizierte Anwendung.“ Aber der Sensor bietet noch mehr: Nicht nur Blut (entweder in Form von Plasma oder direkt als Vollblut) ist als Ausgangsmaterial geeignet, sondern auch nicht-invasive Proben wie Speichel, Urin oder sogar Atemgas. Vor allem Letzteres eröffnet neue Optionen für die zeitnahe Überwachung wirksamer Antibiotika-Pegel im Körper. Bisher ist dies nur mittels Plasmaanalyse möglich. Urinproben eignen sich nicht für ein akutes Monitoring, da es zu lange dauert, bis das Blut in den Nieren filtriert ist und die Stoffe ausgeschieden werden. Auch im Speichel kommen Substanzen erst mit einiger Verzögerung an. „Die Lunge hingegen ist stark durchblutet, sodass ein schneller Stoffaustausch stattfindet. Mithilfe des empfindlichen Biosensors haben wir jetzt gezeigt, dass eine exakte Korrelation zwischen unseren Messwerten aus dem Atemgaskondensat und denen im Plasma besteht“, berichtet der Mikrosystemtechniker.
Die Untersuchungen wurden beispielhaft an Schweinen durchgeführt, die unterschiedliche Antibiotika-Dosen erhalten hatten. 30 min. lang wurde bei narkotisierten Tieren das Atemgas in einer Maske gesammelt, kondensiert und dann analysiert. Für einen routinemäßigen Einsatz ist dieses Verfahren allerdings zu umständlich. Die Gruppe um Dincer versucht deshalb in einem weiteren Projekt, eine Maske mit integrierten Atemgassensoren zu entwickeln.2) Außerdem soll zukünftig untersucht werden, welchen Einfluss Lungenfunktionsstörungen, wie beispielsweise Asthma, auf die Messergebnisse haben.
Breiter Einsatz des Biosensors möglich
 Mit dem Multiplex-Chip können verschiedene Proben oder unterschiedliche Substanzen untersucht werden. © Patrick Seeger/Universität Freiburg
Mit dem Multiplex-Chip können verschiedene Proben oder unterschiedliche Substanzen untersucht werden. © Patrick Seeger/Universität FreiburgDa das auf dem Biosensor immobilisierte PBP das allgemeine ß-Lactam-Grundgerüst erkennt, können alle Mitglieder dieser Antibiotika-Klasse (unter anderem auch Cephalosporine) detektiert werden, woraus sich ein breites Einsatzgebiet ergibt. Des Weiteren haben die Forschenden bereits einen Multiplex-Chip konstruiert, der vier parallele Kanäle enthält, und mit dem entweder verschiedene Proben oder unterschiedliche Substanzen analysiert werden können. „Unser ultimatives Ziel ist es, neben der Antibiotika-Menge parallel noch andere Parameter, wie beispielsweise Entzündungs- oder Nierenmarker aus einer Probe zu bestimmen“, erläutert Dincer seine Zukunftspläne. „Dies ist vor allem in der Klinik bei Sepsis-Erkrankten oder nach Transplantationen wichtig.“
Im Gespräch betont der Wissenschaftler, dass die Entwicklung des innovativen Biosensors vor allem durch die gute Kooperation der universitären Institute und Kliniken in Freiburg ermöglicht wurde, die in gemeinsamen DFG-Projekten zusammenarbeiten.
Die Maxime „so viel wie nötig, so wenig wie möglich“ ist für den Umgang mit Antibiotika wichtiger denn je. Die Arbeiten der Freiburger Forschenden legen wichtige Grundlagen für eine zukünftige gut dosierte, individuelle Therapie.