„Wir sind mehr als die Summe unserer Gene“, so beschreiben Epigenetiker ihr Forschungsgebiet. Denn nicht nur die in der DNA hinterlegte genetische Information bestimmt unser Aussehen und Verhalten, sondern auch, wann und wo diese abgerufen wird. Epigenetik, zusammengesetzt aus der altgriechischen Vorsilbe „epi“ für „dazu“ und dem Begriff Genetik, ist eine „Zusatzgenetik“. Sie reguliert, wann einzelne Gene aktiviert werden können. Epigenetische Veränderungen in Form von chemischen Modifikationen an bzw. in der Nähe der DNA schaffen somit Bedingungen, die die Transkription erlauben oder verhindern. Im Laufe unserer Entwicklung von der befruchteten Eizelle zum Organismus werden zu bestimmten Zeitpunkten in einzelnen Zellen spezifische epigenetische Modifikationen gesetzt. Nur so ist eine Differenzierung zu unterschiedlichen Zelltypen (z. B. Herz-, Leber-, Hautzellen) möglich, obwohl alle Zellen unseres Körpers dieselbe Erbinformation besitzen. „Sobald einmal die Entscheidung [in eine bestimmte Richtung] gefallen ist, wird sie „erinnert“ und bei der nächsten Zellteilung zuverlässig an die Tochterzellen weitergegeben“, erklärt Dr. Asifa Akhtar, Direktorin am Max-Planck-Institut für Immunbiologie und Epigenetik in Freiburg.
Dosiskompensation der Geschlechtschromosomen ist überlebensnotwendig
Alle Gene unterliegen einer epigenetischen Steuerung. Der am längsten bekannte Regulationsmechanismus ist die DNA-Methylierung. Hierbei wird eine kleine chemische Verbindung (Methylgruppe; -CH3) an einen DNA-Baustein (vorwiegend an Cytosin-Basen) angefügt. Findet diese Modifikation innerhalb regulatorischer Sequenzen statt, wird die Transkription des dazugehörigen Gens unterbunden. Dieser Mechanismus spielt unter anderem bei der X-Chromosom-Inaktivierung in Säugern eine wichtige Rolle. Weibliche Individuen besitzen in ihren Zellen zwei X-Geschlechtschromosomen, männliche Zellen hingegen ein X- und ein Y-Chromosom. Für eine normale Entwicklung des Organismus ist allerdings eine definierte Menge an Genprodukten vom X-Chromosom nötig, das heißt, das genetische Ungleichgewicht zwischen den Geschlechtern muss korrigiert werden. Dies geschieht durch die epigenetische Inaktivierung eines der beiden X-Chromosomen in weiblichen Zellen, ein Prozess der auch als Dosiskompensation bezeichnet wird.
Interessanterweise löst der Modellorganismus der Entwicklungsbiologie, die Fruchtfliege Drosophila melanogaster, dieses Problem anders. Hier wird in den männlichen Zellen die Transkription des einzigen X-Chromosoms zweifach hochreguliert, sodass die daraus resultierende Proteinmenge der Menge in weiblichen Zellen entspricht, die zwei X-Chromosomen besitzen.
Histon-Acetyl-Transferase MOF erleichtert Transkription
In allen Eukaryoten sind die fadenförmigen DNA-Stränge platzsparend in den Chromosomen im Zellkern verpackt. Die kleinste Verpackungseinheit ist das Nukleosom, bestehend aus den Histonen und dem darum gewickelten DNA-Bereich. Die hintereinander aufgereihten Nukleosomen sind zudem mehrfach spiralförmig aufgedreht, sodass das Chromatin eine kompakte Struktur erhält, in der die Gene nicht mehr abgelesen werden können. Wie eng die DNA gebunden ist, und wie dicht die Nukleosomen nebeneinander liegen, wird durch die Eigenschaften der Histone bestimmt. Der kompakte (kondensierte) Zustand entsteht aufgrund der starken Anziehung zwischen den positiv geladenen Histonen und der negativ geladenen DNA.
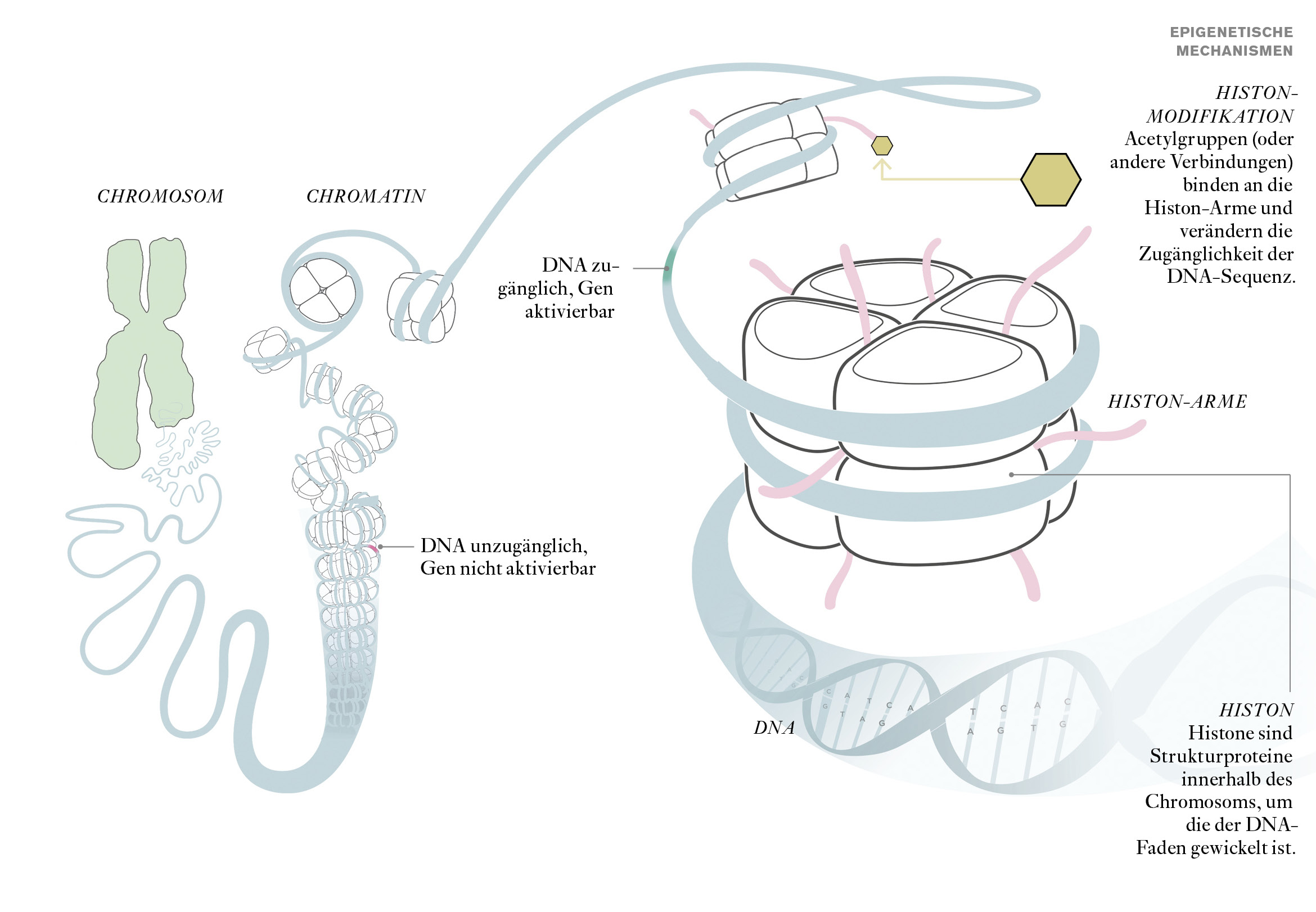 Schematische Darstellung der Organisation von Chromatin und Chromosomen sowie der Histon-Modifikationen. © GCO nach einer Vorlage des MPI für Immunbiologie und Epigenetik.
Schematische Darstellung der Organisation von Chromatin und Chromosomen sowie der Histon-Modifikationen. © GCO nach einer Vorlage des MPI für Immunbiologie und Epigenetik.Für die Aktivierung der Gene des X-Chromosoms in der Fruchtfliege ist der MSL- (Male-specific Lethal) Komplex verantwortlich, der aus mindestens fünf Proteinen (MOF, MSL1, MSL2, MSL3, MLE) sowie zwei nicht-kodierenden RNAs (roX1 und roX2) besteht. Bei MOF (Males-absent on the first Protein) handelt es sich um ein Enzym, eine Histon-Acetyl-Transferase, die eine positive Ladung des Histons durch einen neutralen Acetyl-Rest (-COCH3) ersetzt. Dies schwächt den Kontakt zwischen Histon und DNA und lockert den betroffenen Bereich auf, sodass er für die Transkriptionsmaschinerie zugänglich wird.
Akhtar beschäftigt sich schon seit zwanzig Jahren mit dem Phänomen der Dosiskompensation in Drosophila und dem Enzym MOF. „Mein Fachgebiet ist die Biologie des Chromatins. Die Art und Weise, wie Chromatin geöffnet und geschlossen wird, wie die Zelle die Zugänglichkeit der Gene unterschiedlich kombiniert, das ist der Schlüssel zur epigenetischen Steuerung“, erläutert die Wissenschaftlerin. Mit ihren Arbeiten hat sie viele grundlegende Mechanismen aufgeklärt und wurde dafür im März 2021 mit dem Leibniz-Preis der Deutschen Forschungsgemeinschaft (DFG) ausgezeichnet. Aktuelle Forschungsergebnisse ihrer Gruppe veranschaulichen, wie der MSL-Komplex das X-Chromosom von den Autosomen unterscheiden kann, und warum der Verlust von MOF in Säugern zu Kerninstabilität und Chromosomen-Abnormitäten führt, wie es häufig in Krebszellen der Fall ist.
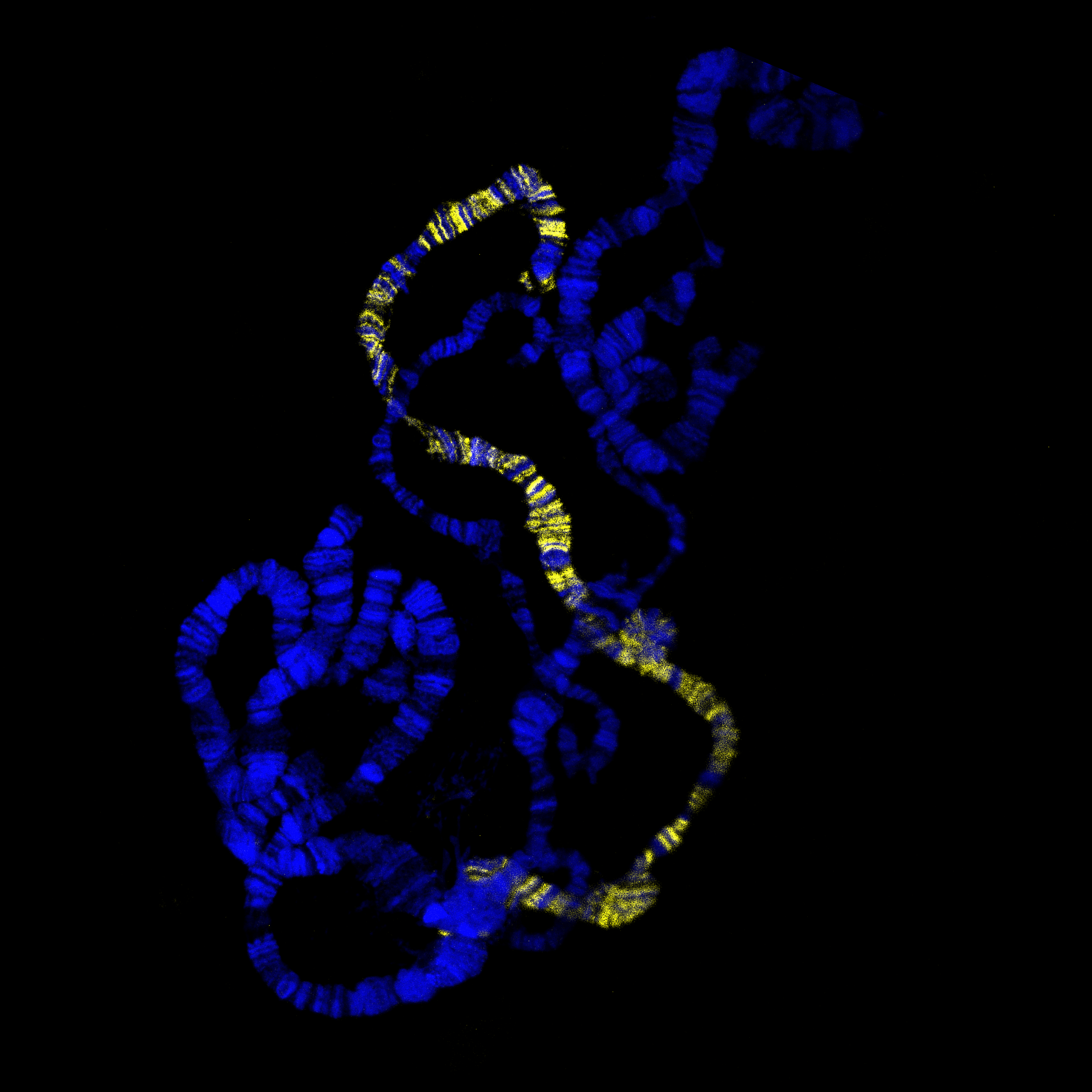 Chromosomen einer männlichen Drosophila Fliege. Der gelb angefärbte MSL-Komplex bindet an das X-Chromosom, die anderen Chromosomen erscheinen in blau. © Aline Gaub, MPI für Immunbiologie und Epigenetik.
Chromosomen einer männlichen Drosophila Fliege. Der gelb angefärbte MSL-Komplex bindet an das X-Chromosom, die anderen Chromosomen erscheinen in blau. © Aline Gaub, MPI für Immunbiologie und Epigenetik.MOF reguliert Transkription in Kern und Mitochondrien
Bereits vor zehn Jahren entdeckte die Arbeitsgruppe von Akhtar, dass das Enzym MOF in Drosophila auch noch Bestandteil des NSL- (Non-specific Lethal) Komplexes ist, der an der Regulation von Genen auf den Autosomen beteiligt ist. Beide Komplexe sind evolutionär konserviert, das heißt sie kommen in sehr ähnlicher Form auch in Säugern vor. In Studien an menschlichen Zellen konnte das Team von Akhtar zeigen, dass der NSL-Komplex nicht nur Gene im Zellkern reguliert, sondern auch in den Mitochondrien. Dies sind membranumschlossene Strukturen in der Zelle, die der Energiegewinnung dienen und eigene DNA besitzen. „Dies führt uns zu einer neuen Ebene in der Biologie, die wir untersuchen können bzw. müssen: die Bedeutung der Kommunikation zwischen Kern und Zytoplasma und zwischen Organellen“, erläutert die Forscherin. Der NSL-Komplex in Säugern scheint als Sensor für die Stoffwechsellage zu dienen und die Gentranskription im Kern und in den Mitochondrien zu koordinieren.
 Dr. Asifa Akhtar, Direktorin am Max-Planck-Institut für Immunbiologie und Epigenetik in Freiburg, untersucht die vielfältigen Funktionen des Enzyms MOF. © Marcus Rockoff, MPI für Immunbiologie und Epigenetik.
Dr. Asifa Akhtar, Direktorin am Max-Planck-Institut für Immunbiologie und Epigenetik in Freiburg, untersucht die vielfältigen Funktionen des Enzyms MOF. © Marcus Rockoff, MPI für Immunbiologie und Epigenetik.Um die Funktionsweise und das Zusammenspiel der Proteine im MSL-Komplex besser zu verstehen, führte das Team von Akhtar unter anderem Strukturanalysen durch, aus denen ersichtlich ist, welche Bereiche der Proteine miteinander interagieren. Diese Erkenntnisse bekamen eine neue Bedeutung, als die Wissenschaftlerin vor einigen Jahren von Ärzten aus Frankreich kontaktiert wurde, die in Kindern mit einem seltenen neurologischen Syndrom Mutationen im Protein MSL3 identifiziert hatten. Aufgrund der vorhandenen Daten war ersichtlich, dass die Veränderungen in MSL3 die Bindung an die Histon-Acetyl-Transferase MOF verhindern. Die Forscher fanden heraus, dass dadurch die enzymatische Aktivität von MOF stark eingeschränkt ist, sodass essenzielle epigenetische Markierungen nur unzureichend gesetzt werden können. Dies verursacht Entwicklungsverzögerungen und fortschreitende neurologische Störungen. „Obwohl es eine genetische Mutation ist, spiegelt sie die epigenetischen Veränderungen am Chromatin wider“, beschreibt Akhtar die Situation. Dadurch eröffnen sich Therapiemöglichkeiten, denn epigenetische Modifikationen können beeinflusst und verändert werden. In Zellkulturexperimenten konnten die Forscher zeigen, dass sogenannte Histon-Deacetylase-Inhibitoren, die die Acetylierung des Histons stabilisieren und normalerweise in der Krebstherapie eingesetzt werden, eine Verbesserung erzielen. Diese Ergebnisse liefern wichtige Ansatzpunkte für erste Behandlungsmöglichkeiten.
Die Entschlüsselung der inzwischen als Basilicata-Akhtar-Syndrom bekannten Erkrankung zeigt, wie wichtig Grundlagenforschung ist. Hierfür bietet das Max-Planck-Institut fantastische Bedingungen und gibt den Forschern Stabilität: „Wir können Fragestellungen in ihrer ganzen Tiefe untersuchen. Dafür bin ich sehr dankbar. […] Es ist wichtig, in gründliche Forschung zu investieren“, erklärt Akhtar, die seit Sommer 2020 Vizepräsidentin der Max-Planck-Gesellschaft ist. Die zusätzliche Unterstützung durch die DFG im Rahmen des MEDEP Sonderforschungsbereiches und des CIBSS (Centre for Integrative Biological Signalling Studies) Excellenzclusters ermöglicht zudem produktive Kooperationen mit vielen Fachbereichen der Universität Freiburg.