Im Kampf gegen COVID-19
Ein neues Immuntherapeutikum zur Behandlung schwerer COVID-19-Fälle
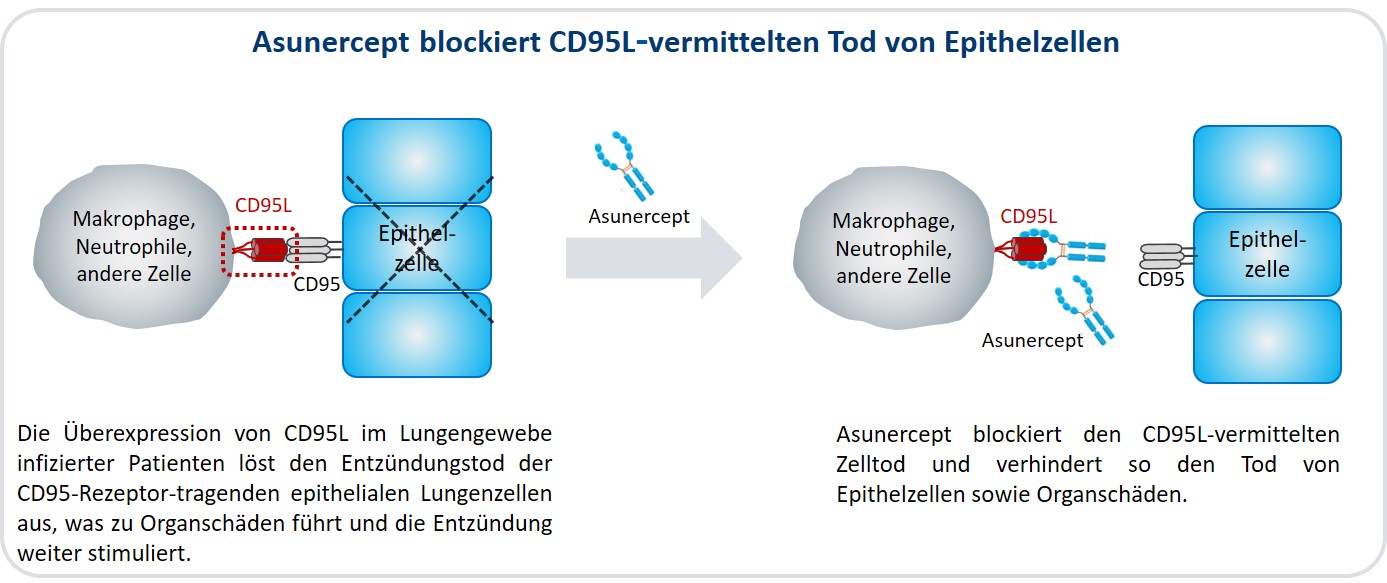
Apogenix, ein auf innovative Immuntherapeutika spezialisiertes biopharmazeutisches Unternehmen in Heidelberg, hat eine klinische Phase II-Studie mit seinem Wirkstoffkandidaten Asunercept zur Behandlung von Patienten mit schwerer COVID-19-Erkrankung begonnen. Das Fusionsprotein blockiert das CD95-Liganden-vermittelte Absterben von Epithelzellen in der Lunge und verhindert somit die Schädigung des Organs.
Zweifellos ist die COVID-19-Pandemie die schlimmste Gesundheitskrise unserer Zeit. Seit Anfang des Jahres, als das neuartige Coronavirus erstmals in Wuhan, Zentralchina, beschrieben worden war, haben sich bis September 2020 nachweislich weit über 25 Millionen Menschen weltweit mit SARS-CoV-2 infiziert, und mehr als 850.000 sind an der vom Virus verursachten COVID-19-Erkrankung verstorben (Angaben von CSSE, Johns Hopkins University Baltimore). Seither erhöht sich die Zahl der Infizierten täglich nochmals um eine Viertelmillion und die der Corona-Toten um sechs- bis achttausend; das entspricht fast den Gesamtzahlen der in Deutschland seit Beginn der Pandemie registrierten Fälle.
Fehlsteuerung des Immunsystems
Wie der Name des Virus besagt (SARS = Severe Acute Respiratory Syndrome), zeichnen sich schwere Krankheitsverläufe durch akute Atemnot aus, die mit einer Lungenentzündung und massiven Schädigungen des Lungenepithels einhergeht. Zusätzlich geht die Erkrankung besonders im Anfangsstadium mit einer Lymphopenie einher, einer stark verringerten Zahl an Lymphozyten im Blut. Wie Studien an chinesischen COVID-19-Patienten gezeigt haben, besteht eine Korrelation zwischen dem Schweregrad der Lymphopenie und der Schwere und dem Ausgang der Erkrankung.
Die Lymphopenie und die Lungenentzündung, die sich in einem akuten Atemnotsyndrom (ARDS) manifestieren, hängen mit einer Fehlregulierung des Immunsystems zusammen. Eine zentrale Rolle spielt dabei der CD95-Ligand (CD95L), dessen natürliche Funktion darin besteht, die Immunhomöostase durch Einleitung des Zelltods reaktiver T-Lymphozyten aufrecht zu erhalten. Durch die Bindung von CD95L an den CD95-Rezeptor (CD95) wird das Selbstmordprogramm (Apoptose) der Zelle aktiviert. CD95L und CD95 sind Mitglieder der Superfamilie des Tumornekrosefaktors und Tumornekrosefaktor-Rezeptors (TNF/TNFR-Superfamilie), die eine wichtige Rolle in der Regulation des Immunsystems und in der Immunabwehr von Tumoren spielen.
Bei Viruserkrankungen wie COVID-19 – ebenso wie bei SARS, MERS oder Grippe – wird durch die Überproduktion von CD95L eine schwere Fehlregulierung des Immunsystems induziert. Im Lungengewebe infizierter Patienten wurde diese Überexpression von CD95L (beispielsweise auf Entzündungszellen wie Neutrophilen und Makrophagen) bereits nachgewiesen. Die dadurch folgende übermäßige CD95L-vermittelte Apoptose von Immun- und Epithelzellen führt zur Dysregulation des Immunsystems und löst entzündliche Zerstörungsprozesse in der Lunge aus. Dadurch kommt es zur Lungenentzündung und zum ARDS.
Apogenix und Asunercept
 Asunercept verhindert CD95L-vermittelte Apoptose von Epithelzellen. © Apogenix
Asunercept verhindert CD95L-vermittelte Apoptose von Epithelzellen. © ApogenixDas auf immuntherapeutische Proteinwirkstoffe spezialisierte biopharmazeutische Unternehmen Apogenix AG in Heidelberg hat seit seiner Gründung 2005 ein vielversprechendes Portfolio an Wirkstoffkandidaten zur Behandlung von Krebs und Viruserkrankungen aufgebaut. Der Effekt dieser Kandidaten beruht auf der Beeinflussung verschiedener Signalwege, die von Komponenten der TNF/TNFR-Superfamilie abhängig sind. Das am weitesten fortgeschrittene Produkt von Apogenix ist der CD95L-Inhibitor Asunercept, ein lösliches, vollständig humanes Fusionsprotein, das aus der extrazellulären Domäne von CD95 und dem Fc-Teil des Immunglobulins G1 zusammengesetzt ist. Asunercept bindet an CD95L, verhindert die Aktivierung von CD95 und blockiert dadurch die von diesem Rezeptor abhängigen Signalketten. So kann es den apoptotischen Zelltod von Immunzellen und Epithelzellen verhindern. Asunercept wurde für die Therapie solider Tumoren und maligner hämatologischer Erkrankungen entwickelt und besitzt den Orphan Drug Status in der Europäischen Union und den USA zur Behandlung von Glioblastomen und myelodysplastischen Syndromen (MDS). Bei MDS handelt es sich um eine heterogene Gruppe maligner Erkrankungen des Knochenmarks; Glioblastome sind besonders bösartige Hirntumoren, die vor allem wegen ihres aggressiven Wachstums und der hohen Neigung zur Rezidivbildung (das Nachwachsen des Krebses nach der Entfernung des Primärtumors) gefürchtet sind. Von der Europäischen Arzneimittelagentur hat der Wirkstoffkandidat „PRIority MEdicine“ -Status (PRIME-Status) für die Behandlung des Glioblastoms erhalten.
Auch bei Patienten mit ARDS bei schweren COVID-19-Erkrankungen könnte Asunercept die mit der Überexpression von CD95L einhergehende Lymphopenie sowie auch den übermäßigen entzündlichen Zelltod der Lungenepithelzellen durch die Blockade des Liganden reduzieren. Die Behandlung von Virusinfektionen wie COVID-19 mit Asunercept stellt einen neuartigen therapeutischen Ansatz dar, der direkt an zwei kritischen krankheitsauslösenden Mechanismen angreift. Er wird jetzt in einer klinischen Studie geprüft.
Die ASUNCTIS-Studie
 Dr. Thomas Höger, Chief Executive Officer der Apogenix AG. © Apogenix
Dr. Thomas Höger, Chief Executive Officer der Apogenix AG. © ApogenixIm Juli 2020 hat Apogenix bekannt gegeben, dass das Unternehmen die Genehmigung zum Start einer klinischen Phase II-Studie erhalten hat, um die Wirksamkeit und Sicherheit von Asunercept bei schwer an COVID-19 erkrankten Patienten zu prüfen. Bei dieser Studie mit dem Namen ASUNCTIS handelt es sich um eine offene, randomisierte, kontrollierte, multizentrische Studie an 400 Patienten in Russland und Spanien. Die Patienten werden gleichmäßig auf vier Behandlungsgruppen aufgeteilt: Bei drei Patientengruppen werden drei verschiedene Dosierungen an Asunercept eingesetzt, die vierte Gruppe erhält den Wirkstoff nicht. Primärer Endpunkt, also das Hauptziel der klinischen Studie, ist die Zeit bis zu einer anhaltenden klinischen Verbesserung um mindestens eine Kategorie an zwei aufeinanderfolgenden Tagen; gemessen wird anhand der 7-Punkte-Skala der Weltgesundheitsorganisation ab der Aufnahme ins Krankenhaus bis zum Tag 29. Zu den Wirksamkeits-Endpunkten der ASUNCTIS-Studie gehören - neben der Beurteilung der Patienten nach dem „National Early Warning Score“ – die Sauerstoffversorgung und die Notwendigkeit mechanischer Beatmung, die Aufenthaltsdauer im Krankenhaus und auf der Intensivstation, der Prozentsatz an Patienten auf der Intensivstation sowie die Mortalität an den Tagen 15 und 29. Dr. Thomas Höger, Chief Executive Officer der Apogenix AG, betonte, dass bereits in klinischen Studien bei Patienten mit rezidivierendem Glioblastom und mit MDS die ausgezeichnete Sicherheit und Verträglichkeit sowie ein deutlicher Trend zur Wirksamkeit von Asunercept nachgewiesen worden war. Über die ASUNCTIS-Studie sagte er: „Wir freuen uns sehr über die Genehmigung seitens der russischen und spanischen Zulassungsbehörden, mit unserem am weitesten entwickelten Immuntherapiekandidaten Asunercept die erste klinische Studie bei Patienten mit schwerer COVID-19-Erkrankung zu beginnen und sind zuversichtlich, dass sich Asunercept bei COVID-19-Patienten als wirksam erweisen wird.“