Neues Analyseverfahren aus Blutproben
Liquid Biopsy soll personalisiertes Therapiemonitoring bei Schwarzem Hautkrebs ermöglichen
Durch die Immuntherapie haben sich die Überlebensaussichten von Patienten mit schwarzem Hautkrebs extrem verbessert. Um den Therapieverlauf möglichst gut überwachen zu können, wurde jetzt an der Universitäts-Hautklinik Tübingen eine Studie gestartet, die zusätzlich zu den herkömmlichen PET/CT-Untersuchungen ein personalisiertes Monitoring mittels Liquid Biopsy einsetzt. Dieses Analyseverfahren aus Blutproben könnte eine engmaschigere Kontrolle und somit frühzeitigere Erkennung von Rückfällen ohne zusätzliche radiologische Diagnostik ermöglichen.
Der schwarze Hautkrebs (malignes Melanom) ist ein außerordentlich bösartiger Tumor der Pigmentzellen der Haut (Melanozyten). Solange sich der Tumor noch in der obersten Hautschicht befindet, sind die Heilungschancen sehr gut, da er chirurgisch entfernt werden kann. Hat das schnell wachsende Melanom allerdings die Barriere zur darunterliegenden Lederhaut durchbrochen und bekommt somit Kontakt zu den dort befindlichen Blut- und Lymphgefäßen, verschlechtern sich die Prognosen für den Patienten dramatisch. Die aggressiven Krebszellen wandern dann durch den Körper und können in anderen Organen Metastasen bilden. In diesem Stadium kamen lange Zeit hauptsächlich Chemo- und Strahlentherapien zum Einsatz, die oft aber nur kurzzeitige Besserung erzielten. Seit knapp zehn Jahren gibt es allerdings die Möglichkeit zur Immuncheckpoint-Blockade, wodurch sich die Überlebenschancen der Patienten deutlich verbessert haben. Dieser Therapieansatz zielt auf die Aktivierung des körpereigenen Immunsystems zur Bekämpfung der Krebszellen ab.
Checkpoint-Inhibitoren hemmen eine Bremse des Immunsystems
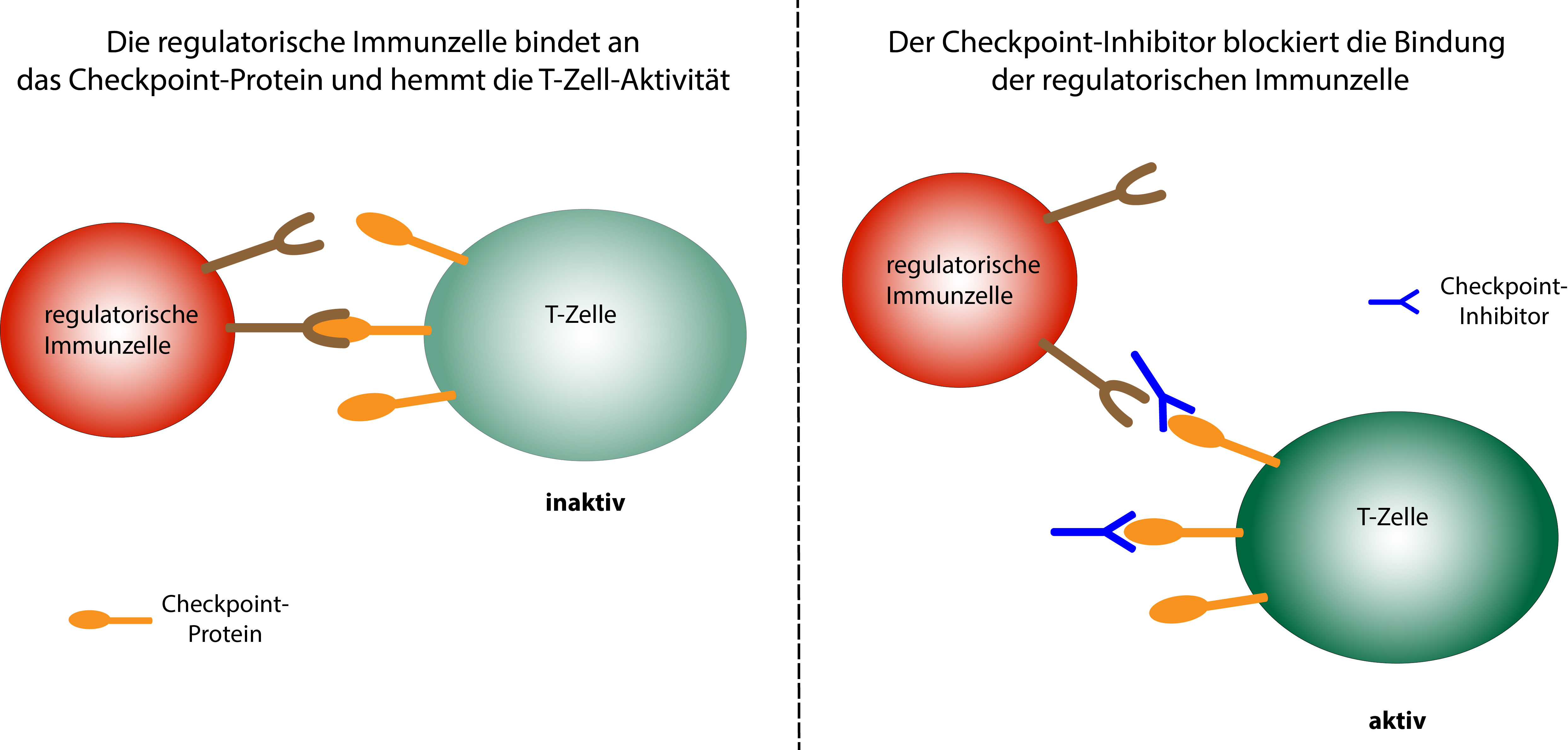 Schematische Darstellung der Wirkungsweise von Checkpoint-Inhibitoren. © Dr. Ruth Menßen-Franz
Schematische Darstellung der Wirkungsweise von Checkpoint-Inhibitoren. © Dr. Ruth Menßen-FranzKrebszellen besitzen auf ihrer Oberfläche veränderte Proteinstrukturen, die von den körpereigenen Immunzellen als fremd erkannt werden und eine Immunantwort auslösen. Um eine überschießende Reaktion des Körpers mit zum Teil lebensbedrohlichen Folgen zu vermeiden, besitzt das Immunsystem eine Reihe hemmender Kontrollpunkte, sogenannte „Checkpoints“, die die Immunantwort mit zeitlicher Verzögerung wieder abschwächen, so dass kein gesundes Gewebe zerstört wird. Auf der Oberfläche aktiver T-Immunzellen befinden sich verschiedene Checkpoint-Proteine, deren Bindung durch regulatorische Immunzellen die T-Zell-Aktivität bremst. Spezielle Antikörper, die ebenfalls an diese Checkpoint-Proteine binden, wirken als Checkpoint-Inhibitoren, denn sie blockieren die Erkennung durch die regulatorischen Immunzellen und verhindern so das Auslösen hemmender Signale. Die Immunantwort hält also länger an, und Krebszellen können effektiver bekämpft werden.
 Dr. Andrea Forschner leitet die Melanom-Ambulanz der Universitäts-Hautklinik Tübingen. © Dr. Andrea Forschner
Dr. Andrea Forschner leitet die Melanom-Ambulanz der Universitäts-Hautklinik Tübingen. © Dr. Andrea ForschnerWerden unterschiedliche Checkpoint-Inhibitoren kombiniert verabreicht, wie beispielsweise bei der Therapie des metastasierenden Melanoms, steigen die Chancen für die Patienten enorm. Mehr als die Hälfte der Patienten spricht normalerweise auf die Behandlung an, und bei 22 Prozent darf man sogar eine Komplettremission mit Rückbildung aller Metastasen erwarten. „Die Immuncheckpoint-Blockade hat die Prognose der Patienten extrem verbessert. Fünfjahres-Überlebensraten von 60 Prozent waren früher undenkbar“, erläutert Dr. Andrea Forschner, seit 2015 Leiterin der Melanom-Ambulanz der Universitäts-Hautklinik Tübingen. „Aber wo Licht ist, ist auch Schatten. Bei hohen Ansprechraten muss man im Blick behalten, dass mehr als die Hälfte der Patienten mit Kombinationstherapie auch sehr schwere Nebenwirkungen entwickeln.“ Zu diesen zählen vor allem autoimmunvermittelte Darmentzündungen mit schweren Durchfällen, aber auch Entzündungen von Lunge, Haut, Niere oder Hirnhaut. Da die feine Balance zwischen Aktivierung und Hemmung der Immunantwort durch die Checkpoint-Blockade außer Kontrolle gerät, greifen die aktivierten Immunzellen mitunter auch gesundes Gewebe an. Mit hoch dosiertem Kortison kann dem entgegengesteuert werden, teilweise muss allerdings die Immuntherapie unterbrochen oder sogar komplett eingestellt werden. Trotz der bisweilen starken Nebenwirkungen sind die langfristigen Erfolgsaussichten dieses Behandlungsansatzes aber enorm.
Liquid Biopsy als begleitendes Nachweisverfahren
Vor Beginn der Behandlung mit Immuncheckpoint-Inhibitoren und nach zwölf Wochen Therapie wird jeweils eine PET/CT- (Positronen-Emissions-Tomografie kombiniert mit Computertomografie) Untersuchung durchgeführt. In diesem aufwendigen radiologischen Verfahren können Metastasen aufgrund ihrer Stoffwechselaktivität dargestellt werden. Momentan erfolgen nach Abschluss der Therapie erst alle drei, später alle sechs Monate weitere PET/CT-Kontrollen. „Wir sehen allerdings, dass die Patienten, selbst wenn sie ein gutes Ansprechen haben, [….] extrem belastet sind. Sie wissen nicht, ist [die Remission] dauerhaft, oder gibt es ein Rezidiv? Die sechs Monate zwischen den Kontrolluntersuchungen sind eine lange Zeit“, erklärt die Ärztin, die berufsbegleitend auch eine Weiterbildung zur Psychoonkologin absolviert hat. Aus diesem Grund wären weitere Verfahren zur Überwachung des Therapieerfolgs wünschenswert. Dementsprechend wurde an der Universitätsklinik Tübingen eine Studie ins Leben gerufen, die den Verlauf der Therapie zusätzlich mittels Liquid Biopsy (Flüssigbiopsie), einer neuen hoch sensitiven Analysemethode des Bluts, untersucht.
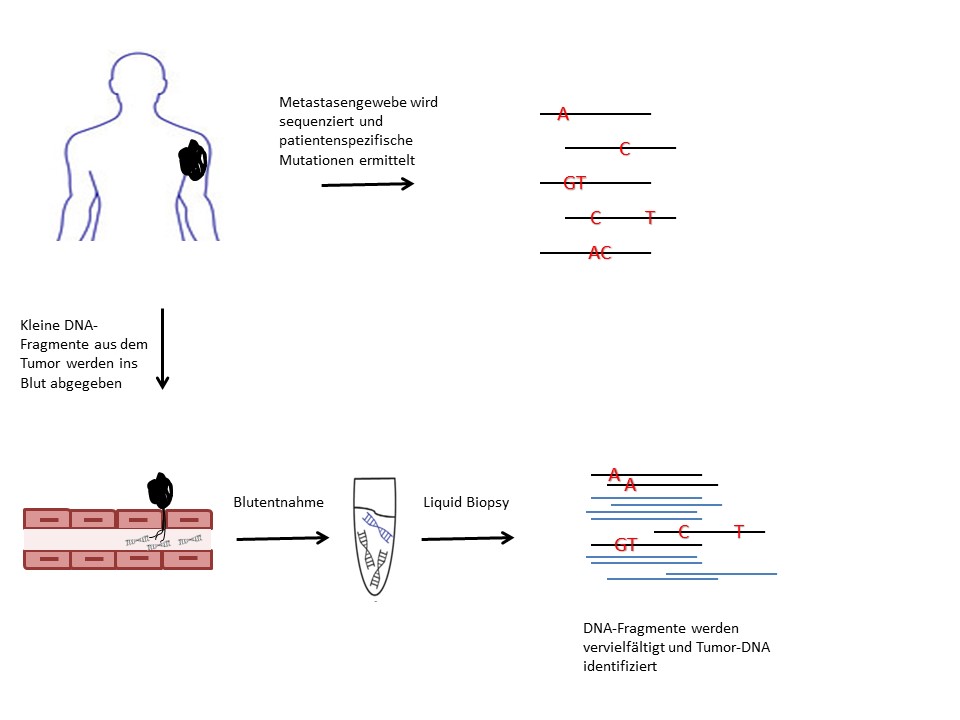 Im Rahmen der Liquid Biopsy kann Tumor-DNA (schwarz) aus einer Blutprobe aufgrund spezifischer Mutationen nachgewiesen werden. © Dr. Andrea Forschner
Im Rahmen der Liquid Biopsy kann Tumor-DNA (schwarz) aus einer Blutprobe aufgrund spezifischer Mutationen nachgewiesen werden. © Dr. Andrea ForschnerFür die detaillierte Diagnose eines Tumors wird üblicherweise eine Gewebeprobe (Biopsie) entnommen und auf tumorspezifische Eigenschaften untersucht. Hierzu zählen vor allem Veränderungen in der DNA der Tumorzellen, sogenannte Treibermutationen, die heutzutage mittels Hochdurchsatz-Sequenzierung (Next Generation Sequencing NGS) gut identifiziert werden können. Der Tumor gibt kleinste Mengen seiner DNA ins Blut ab, die sich mittels Liquid Biopsy anhand der Mutationen direkt aus einer Blutprobe nachweisen lässt.
Für alle Patienten werden fünf bis zehn individuelle Treibermutationen ausgewählt. Bei jeder Infusion und bei jeder Laborkontrolle in der Therapiepause erfolgt die Abnahme eines speziellen Blutröhrchens für die Liquid Biopsy, sodass der Therapieverlauf ohne zusätzlichen Aufwand für den Patienten in kürzeren Intervallen untersucht werden kann. „Wir hoffen, dass wir mit der Studie eine [Monitoring]-Methode entwickeln können, mit der wir den Patienten in den therapiefreien Intervallen eine größere Sicherheit geben und Rezidive rechtzeitig erkennen können“, beschreibt Forschner das Projekt, das sie zusammen mit Prof. Dr. Christina Pfannenberg vom PET/CT-Zentrum der Universitätsklinik Tübingen leitet. Durchgeführt wird die Liquid Biopsy im Institut für Medizinische Genetik unter Leitung von Prof. Dr. Olaf Rieß und Dr. Christopher Schroeder. Finanzielle Unterstützung erhält sie von der Bristol-Myers Squibb-Stiftung Immunonkologie. Bewährt sich das personalisierte Therapiemonitoring mittels Liquid Biopsy bei der Behandlung metastasierender Melanompatienten, kann es in Zukunft hoffentlich in der klinischen Routine eingesetzt werden.