Signalmechanismen bei Entzündungsprozessen
Neu entdeckte Wirkstoffe aktivieren das Inflammasom in Makrophagen
Unterschwellige chronische Entzündungen, verursacht von Komponenten des angeborenen Immunsystems, können langfristig eine Vielzahl von Erkrankungen begünstigen. Auf der Suche nach den Signalmechanismen, die diesen Entzündungsprozessen zugrunde liegen, entdeckte die Arbeitsgruppe von Prof. Dr. Olaf Groß am Universitätsklinikum Freiburg neue Wirkstoffe mit immunstimulierenden Eigenschaften, die zusätzliche Möglichkeiten in der Krebsimmuntherapie eröffnen können.
 Prof. Dr. Olaf Groß hat neue immunstimulierende Wirkstoffe entdeckt. © CIBSS, Universität Freiburg
Prof. Dr. Olaf Groß hat neue immunstimulierende Wirkstoffe entdeckt. © CIBSS, Universität Freiburg„Wir sind nicht gemacht für diese Welt, die wir uns gebaut haben. Die Evolution hat uns an diesen Lebensstil nicht angepasst“, beschreibt Prof. Dr. Olaf Groß unsere Lebenssituation, die mit zunehmendem Alter häufig geprägt ist von Zivilisationskrankheiten wie Typ-2-Diabetes, Arteriosklerose oder Gicht, aber auch Krebserkrankungen. Vielen dieser Erkrankungen liegt eine chronische, unterschwellige Immunaktivität typischerweise in Form einer Entzündung zugrunde, die über Jahrzehnte beschwerdefrei verlief und unbemerkt Schäden im Gewebe verursachte. Erst mit zunehmendem Alter werden die Folgen sichtbar. Antreiber der Entzündungsreaktionen sind unter anderem Makrophagen, spezielle Fresszellen des angeborenen Immunsystems. Zusammen mit natürlichen Killerzellen, Granulozyten, Mastzellen und anderen Immunzellen wehren sie Schadstoffe und Krankheitserreger (Pathogene) unmittelbar mit Hilfe ererbter Erkennungsmechanismen ab. Im Gegensatz dazu steht die von T- und B-Lymphozyten vermittelte erworbene Immunabwehr. Diese erzeugt, unter anderem durch die Bildung von Antikörpern, eine maßgeschneiderte Immunantwort. Die Zellen beider Teile des Immunsystems kommunizieren über lösliche Botenstoffe, sogenannte Zytokine, miteinander und mit anderen Teilen des Körpers.
Das NLRP3 Inflammasom verursacht sterile Entzündungen
Makrophagen schütten nach ihrer Aktivierung entzündungsfördernde Zytokine aus. Diese locken andere Immunzellen an und aktivieren diese, sodass Eindringlinge oder auch Krebszellen gezielt bekämpft werden können. Besonders wirksam sind die Zytokine der Interleukin-1 (IL-1)-Familie, allen voran IL-1β. Die Ausschüttung von IL-1β wird durch das Inflammasom gesteuert, ein Multiproteinkomplex im Zytosol der Makrophagen, der sich aus jeweils mehreren Kopien eines Sensormoleküls, des Adapterproteins ASC, und der inaktiven Vorstufe des Enzyms Caspase-1 zusammensetzt. Der Komplex bildet sich erst, nachdem die Zelle Gefahrensignale, ausgehend von Pathogenen oder Schadstoffen, erkannt hat und führt zur Aktivierung von Caspase-1. Diese produziert reifes IL-1β und spaltet Gasdermin-D, ein Protein, das daraufhin Poren in der Zellmembran bildet, durch die die Zytokine austreten können.
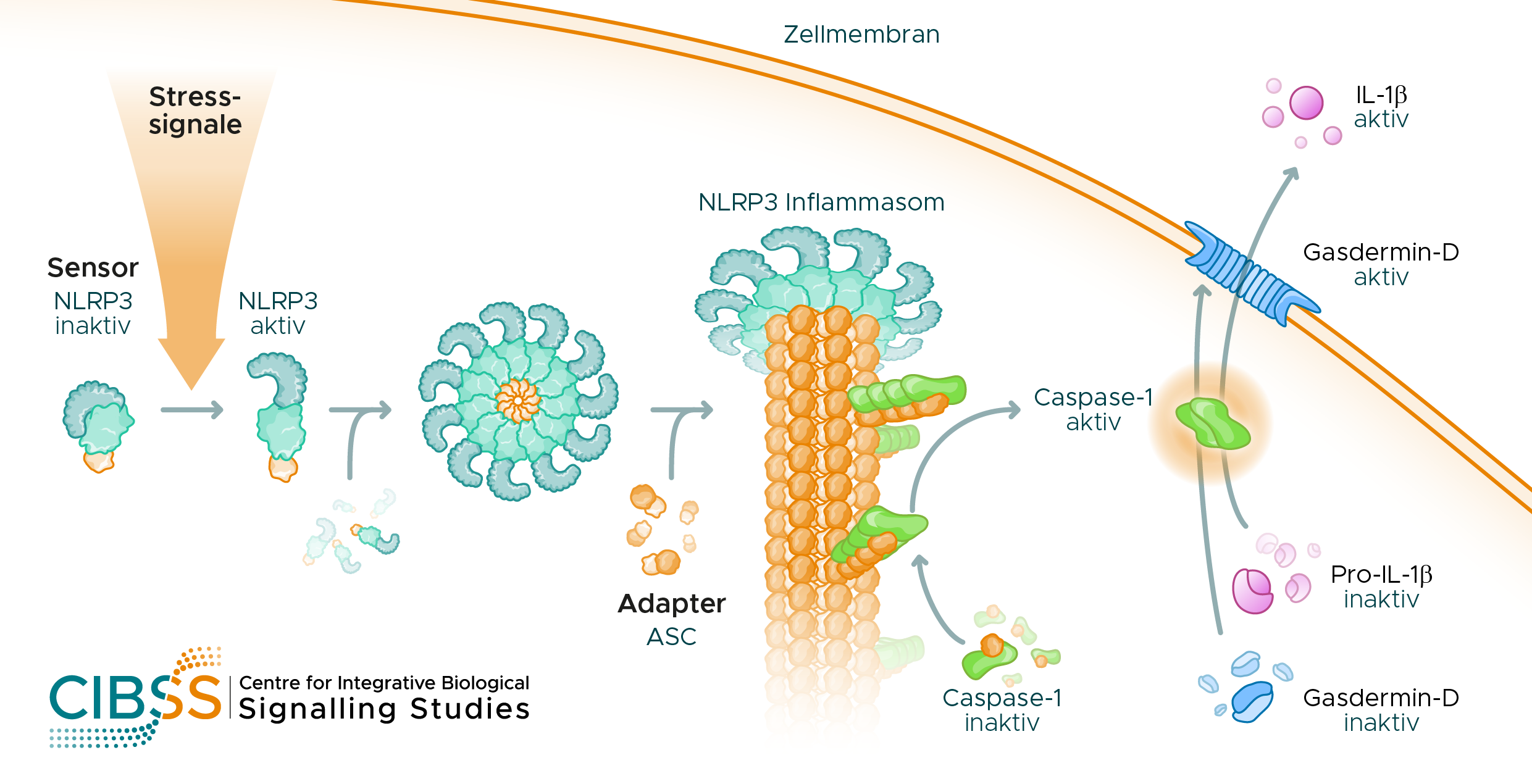 Mechanismus der Interleukin-1β (IL-1β) - Ausschüttung in Makrophagen. Nach der Detektion von Stress-Signalen durch das Sensormolekül NLRP3 assembliert der NLRP3 Inflammasom-Komplex und aktiviert Caspase-1. Diese aktiviert IL-1β und spaltet Gasdermin-D, das daraufhin Poren in der Zellmembran bildet, durch die IL-1β ausgeschüttet wird. © CIBSS, Universität Freiburg
Mechanismus der Interleukin-1β (IL-1β) - Ausschüttung in Makrophagen. Nach der Detektion von Stress-Signalen durch das Sensormolekül NLRP3 assembliert der NLRP3 Inflammasom-Komplex und aktiviert Caspase-1. Diese aktiviert IL-1β und spaltet Gasdermin-D, das daraufhin Poren in der Zellmembran bildet, durch die IL-1β ausgeschüttet wird. © CIBSS, Universität FreiburgAbhängig vom Sensormolekül unterscheidet man unterschiedliche Arten des Inflammasoms in Makrophagen. Das für chronische Entzündungen verantwortliche NLRP3 Inflammasom reagiert in erster Linie auf Reizstoffe statt auf Pathogene, es verursacht sogenannte sterile Entzündungen. Asbest beispielsweise löst so eine Entzündung des Lungengewebes aus, die langfristig zu Lungenkrebs führen kann. Entzündungen aufgrund von Harnsäure- oder Cholesterinkristallen dagegen verstärken die Symptome und Folgen von Gicht oder Arteriosklerose. Medizinisch ist das NLRP3 Inflammasom von großer Bedeutung, da seine kontinuierliche Aktivierung einer Vielzahl von Erkrankungen Vorschub leistet. Normalerweise sind Immunreaktionen fein ausbalanciert; sie müssen stark genug sein, um eine gute Abwehr zu erzeugen, dürfen aber nicht stärker bzw. länger andauern als notwendig, um den Körper nicht zu schädigen. „Wir verstehen nicht, warum das Immunsystem es nicht schafft, diese unterschwelligen Entzündungen abzuschalten“, erklärt Groß, der sich schon seit seiner Postdoktorandenzeit intensiv mit dem NLRP3 Inflammasom beschäftigt und seit 2017 eine Arbeitsgruppe am Institut für Neuropathologie des Universitätsklinikum Freiburg leitet.
Neue Aktivatoren des NLRP3 Inflammasoms gefunden
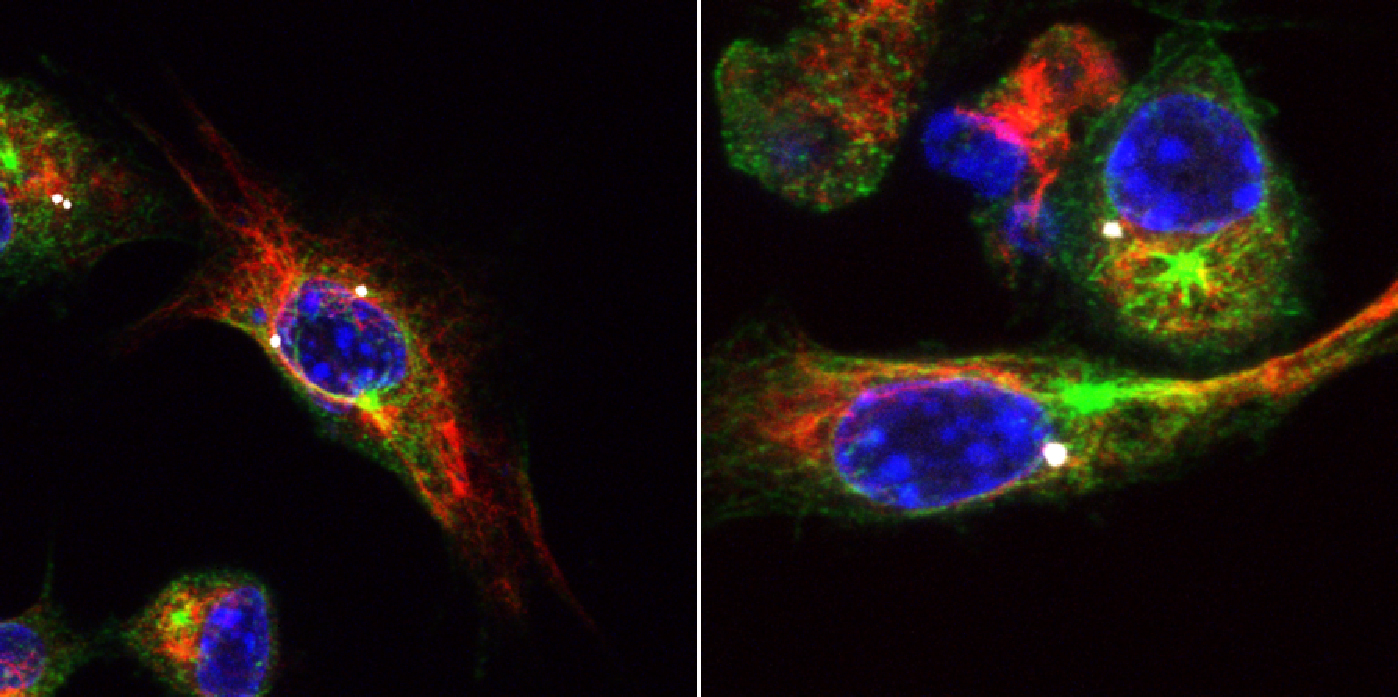 Makrophagen nach Inflammasom-Aktivierung. Fluoreszenzmikroskopische Aufnahme mit aktiviertem Inflammasom (weiß), Zellkernen (blau) und den Strukturproteinen Tubulin (grün) und β-Aktin (rot). © CIBSS, Universität Freiburg
Makrophagen nach Inflammasom-Aktivierung. Fluoreszenzmikroskopische Aufnahme mit aktiviertem Inflammasom (weiß), Zellkernen (blau) und den Strukturproteinen Tubulin (grün) und β-Aktin (rot). © CIBSS, Universität FreiburgBisher gibt es keine zugelassenen Medikamente, die das NLRP3 Inflammasom hemmen können, auch weil die auslösenden Signalketten noch unbekannt sind. „Die Strategie meines Labors ist es, den Mechanismus von Aktivatoren zu untersuchen, um besser verstehen zu können, was NLRP3 sieht. Wenn ich das mechanistisch verstanden habe, kann ich bessere Inhibitoren entwickeln“, erläutert der Grundlagenforscher. Auf der Suche nach Wirkstoffen, die das NLRP3 Inflammasom aktivieren, hat sein Team ein neues Testverfahren entwickelt und damit eine Sammlung aus 50.000 chemischen Substanzen untersucht. In diesem „Compound Screen“ konnten die Wissenschaftler mehrere Molekülklassen identifizieren, die eine deutlich bessere Wirksamkeit und auch Spezifität aufzeigen als die bisher bekannten Aktivatoren. Eine der großen Aufgaben der nächsten Jahre ist die Entschlüsselung des Signalmechanismus einschließlich direkter Interaktionspartner, um so eine Grundlage für die Entwicklung von Inhibitoren zu schaffen. Dies wird vor allem im Rahmen und in Zusammenarbeit mit anderen Gruppen des Exzellenzclusters CIBSS (Centre for Integrative Biological Signalling Studies) der Universität Freiburg stattfinden.
Einsatz in der Krebstherapie möglich
Die gefundenen Aktivatoren können möglicherweise aber auch direkt zur Unterstützung von Krebsbehandlungen eingesetzt werden. In der Mikroumgebung von malignen (bösartigen) Tumoren befinden sich verschiedenste Immunzellen, deren Funktion allerdings von den Tumorzellen manipuliert werden kann. Diese senden Signale aus, die die Immunzellen ausschalten oder im Fall von Makrophagen sogar umprogrammieren können, sodass letztere tumorfördernde Eigenschaften erhalten. Tumorassoziierte Makrophagen stellen daher einen wichtigen Angriffspunkt in der Krebstherapie dar. Eine spezifische Aktivierung des NLRP3 Inflammasoms mit Hilfe der neu entdeckten Wirkstoffe könnte das Immunsystem wieder auf den richtigen Weg bringen.
Mit Hinblick auf den zukünftigen therapeutischen Einsatz hat Groß nun einen Patentantrag eingereicht. Denn: „Nichtpatentierte Forschung ist im Grunde wertlos für die Industrie. Wenn die Rechte nicht gesichert sind, dann ist die Motivation sehr gering, die Grundlagenkenntnisse in Richtung Markt weiterzuentwickeln.“ Aufbauend auf eine vorhergehende Förderung durch den European Research Council (ERC) erhielt der Forscher jetzt einen „ERC Proof of Concept Grant". Dieser unterstützt speziell Arbeiten, die über die Grundlagenforschung hinausgehen. In den nächsten Monaten wird nun untersucht, wie verträglich die NLRP3 Inflammasom-Aktivatoren sind, und ob sie bestehende Krebstherapien oder eventuell auch die Immunantwort auf Impfstoffe verbessern können. Diese vorklinischen Daten steigern das Marktpotenzial und schaffen damit eine Grundlage für die Gewinnung von Investoren. Außerdem ist geplant, die Substanzen chemisch weiterzuentwickeln, um ihre Wirksamkeit und Spezifität und damit ihre Verträglichkeit zu erhöhen. Die gezielte Aktivierung der Makrophagen des angeborenen Immunsystems könnte in vielen therapeutischen Bereichen neue Möglichkeiten eröffnen.