Computer-Tool schafft neue Perspektiven gegen Antibiotikaresistenzen
PhARIS identifiziert wirksame Phagen gegen multiresistente Keime
Bakteriophagen, also Viren, die gezielt Bakterien infizieren und vernichten, rücken auf der Suche nach alternativen Behandlungsmethoden gegen antibiotikaresistente Krankheitserreger immer mehr in den Fokus. Das von Forschenden der Universität Tübingen entwickelte Analyseprogramm PhARIS kann spezifische Phagen gegen den Krankenhauskeim Staphylococcus aureus anhand ihrer Erbinformation identifizieren und so die Entwicklung von Phagentherapien deutlich beschleunigen.
Immer häufiger zeigen Medikamente keine Wirkung mehr gegenüber Bakterien, Viren oder auch Pilzen. Solche antimikrobiellen Resistenzen (AMR) stellen derzeit eine der größten Bedrohungen für die globale Gesundheit dar. Nach Schätzungen des internationalen Forschungskonsortiums Global Burden of Disease (GBD) waren im Jahr 2021 weltweit zwischen 4 und 7,1 Mio. Todesfällen allein mit bakterieller AMR assoziiert.1) Vor allem Methicillin-resistente Staphylococcus aureus-Erreger (MRSA) nehmen stark zu und verursachen mittlerweile mehr als elf Prozent der tödlich verlaufenden Infektionen.1)
In der Regel sind die gram-positiven kugelförmigen S. aureus-Bakterien harmlos: Bei einem Drittel der Bevölkerung besiedeln sie als Teil des normalen Mikrobioms die Nase oder Haut. Erst in Kombination mit einem geschwächten Immunsystem oder einer gestörten Hautbarriere kann es nicht nur zu lokalen Infektionen, sondern auch zu lebensbedrohlichen Erkrankungen wie Blutvergiftungen, Herzinnenhautentzündungen oder dem toxischen Schocksyndrom kommen. Aktuell sind bereits 80 Prozent der S. aureus-Stämme resistent gegenüber Penicillin.2) Kommen dann noch Resistenzen gegen weitere ß-Lactam-Antibiotika (wie Methicillin und Clindamycin) oder Substanzen aus anderen Wirkstoffklassen (z. B. Erythromycin oder Chinolone) dazu, sind die multiresistenten Erreger nur noch schwer zu bekämpfen. MRSA tritt hauptsächlich in Krankenhäusern auf. In Deutschland beträgt der Anteil dort inzwischen mehr als 20 Prozent aller S. aureus-Infektionen.2)
Mit Phagen gegen Bakterien
„Die Zahlen steigen immer weiter, und wir müssen dringend alternative Behandlungsansätze finden“, berichtet Prof. Dr. Andreas Peschel vom Interfakultären Institut für Mikrobiologie und Infektionsmedizin der Universität Tübingen (IMIT). Zusammen mit anderen Arbeitsgruppen will er deshalb im Exzellenzcluster „Kontrolle von Mikroorganismen zur Bekämpfung von Infektionen (CMFI)“ neue Strategien entwickeln, um gezielter einzelne Erreger zu eliminieren. „Derzeitige Antibiotika haben zumeist ein breites Wirkspektrum und schädigen immer auch unser gesundheitsförderndes Darm-Mikrobiom. Wir suchen nach engmaschig wirkenden Konzepten, die spezifisch pathogene Keime ausschalten.“
 Ein Team um Prof. Dr. Andreas Peschel (links) und den Doktoranden Janes Krusche (rechts) vom Interfakultären Institut für Mikrobiologie und Infektionsmedizin (IMIT) der Universität Tübingen hat das Computer-Tool PhARIS entwickelt, mit dem sich spezifische Phagen gegen den Krankenhauskeim S. aureus identifizieren lassen. © Jörn Jäger/Universität Tübingen (links); Leon Kokkoliadis/Universität Tübingen (rechts)
Ein Team um Prof. Dr. Andreas Peschel (links) und den Doktoranden Janes Krusche (rechts) vom Interfakultären Institut für Mikrobiologie und Infektionsmedizin (IMIT) der Universität Tübingen hat das Computer-Tool PhARIS entwickelt, mit dem sich spezifische Phagen gegen den Krankenhauskeim S. aureus identifizieren lassen. © Jörn Jäger/Universität Tübingen (links); Leon Kokkoliadis/Universität Tübingen (rechts)Peschel und sein Team beschäftigen sich mit Bakteriophagen, also speziellen Viren, die nur Bakterien infizieren und diese abtöten können. Bereits 1915 wurden die antibakteriellen Eigenschaften einer neuartigen Substanz von dem Engländer Frederik Twort sowie zwei Jahre später von dem Frankokanadier Félix D´Hérelle beschrieben.3) Trotz einiger erfolgreicher Behandlungen mit den als Bakterienfressern (von altgriechisch phagein = fressen) titulierten Viren, geriet die Phagentherapie mit dem Aufkommen der Antibiotika in den westlichen Ländern immer mehr in Vergessenheit. In den Nachfolgestaaten der ehemaligen Sowjetunion hingegen, insbesondere in Georgien, wurde die Behandlungsmethode weiterentwickelt und kommt auch heutzutage vielfach und sehr erfolgreich zum Einsatz.
Im Zuge der steigenden Antibiotikaresistenzen wächst das weltweite Interesse an Phagen allerdings stetig. Doch ihr Einsatz ist mit einigen Herausforderungen verbunden. Biologe Peschel erläutert: „Phagen sind viel größer als ein Antibiotikum und können nicht so leicht ins Gewebe eindringen. Deshalb sind sie vorwiegend für oberflächliche Infektionen geeignet oder für solche, die über den Blutstrom erreichbar sind. Sie werden zudem in Bakterien herangezogen, und es ist bisher sehr schwierig, die Präparate in gleichbleibender Qualität herzustellen. Dies ist ein großes Hindernis für die Zulassung als Arzneimittel. Vor allem aber sind Phagen sehr spezifisch und infizieren nur bestimmte Bakterienarten oder sogar nur spezielle Subtypen.“
Analyseprogramm PhARIS findet geeignete Phagen
 PhARIS (Phage Aureus RBP Identification System) analysiert anhand der genetischen Information der Phagen ihre Rezeptorbindeproteine und findet so passende Kandidaten, die S. aureus infizieren und vernichten können. © Dr. Johannes Richers und Dr. Christoph Kuehne (Jo Richers Studio), im Auftrag der Universität Tübingen/CMFI
PhARIS (Phage Aureus RBP Identification System) analysiert anhand der genetischen Information der Phagen ihre Rezeptorbindeproteine und findet so passende Kandidaten, die S. aureus infizieren und vernichten können. © Dr. Johannes Richers und Dr. Christoph Kuehne (Jo Richers Studio), im Auftrag der Universität Tübingen/CMFIDie hohe Spezifität der Viren bietet Schutz für das menschliche Mikrobiom, aber sie erschwert die routinemäßige Anwendung enorm. Bisher muss nach Isolierung des Erregers in einem Trial-and-Error-Verfahren der passende Phage bestimmt werden. Dies kann sich über Tage oder auch Wochen hinziehen, da es Hunderte möglicher Kandidaten gibt. Der Doktorand Janes Krusche hat jetzt mit PhARIS (Phage Aureus RBP Identification System) ein Analyseprogramm entwickelt, mit dem sich basierend auf dem Erbgut des Virus vorhersagen lässt, welche S. aureus-Variante er infizieren kann.
Fast alle Phagen bestehen aus einem Kopfsegment, das entweder DNA oder RNA als genetische Information enthält, und einem Schwanzteil, auf dem sich sogenannte Rezeptorbindeproteine (RBP) befinden. Diese interagieren spezifisch mit definierten Varianten der zuckerhaltigen Zellwandbausteine von Bakterien. Nach dem irreversiblen Andocken injiziert der Phage dann sein genetisches Material ins Innere des Bakteriums und nutzt dessen Stoffwechselmaschinerie, um sich zu vervielfältigen. Schon nach kurzer Zeit (20 - 30 min) platzt die Wirtszelle, und neue Viruspartikel werden freigesetzt, die wiederum weitere Erreger befallen und vernichten können.
Krusche und seine Kolleginnen und Kollegen identifizierten und analysierten die RBP sowie die dazugehörigen Gene von insgesamt 335 S. aureus-infizierenden Phagen. Des Weiteren klärten sie die molekularen Grundlagen der Bindung an verschiedene Erregerstämme auf und entwickelten auf dieser Basis das Computer-Tool PhARIS. Der Erstautor der im Fachmagazin Cell Reports veröffentlichten Arbeit4) hebt hervor: „Jetzt ist es möglich, bei neuen S. aureus-Phagen nur anhand der genetischen Information vorherzusagen, gegen welche Klone diese aktiv sind. Das beschleunigt die Entwicklung der Therapie enorm.“
Phagentherapie als Teil der Lösung
Das Analyseprogramm ist weltweit frei zugänglich und könnte von großem Nutzen für den breiteren Einsatz von Phagentherapien sein. Auch in Deutschland wird zunehmend an der Etablierung dieser Behandlungsmethode gearbeitet. Im Projekt Phage4Cure beispielsweise wird die Wirkung inhalierbarer Phagen-Cocktails gegen schwere, von multiresistenten Pseudomonas aeruginosa-Keimen verursachte Lungenentzündungen untersucht.5) Bisher sind hierzulande mit Phagen lediglich sogenannte Heilversuche erlaubt, also Behandlungen, die vom medizinischen Standard abweichen. Diese dürfen nur dann an Patientinnen und Patienten mit schweren Erkrankungen durchgeführt werden, wenn zugelassene Therapien nicht anschlagen.
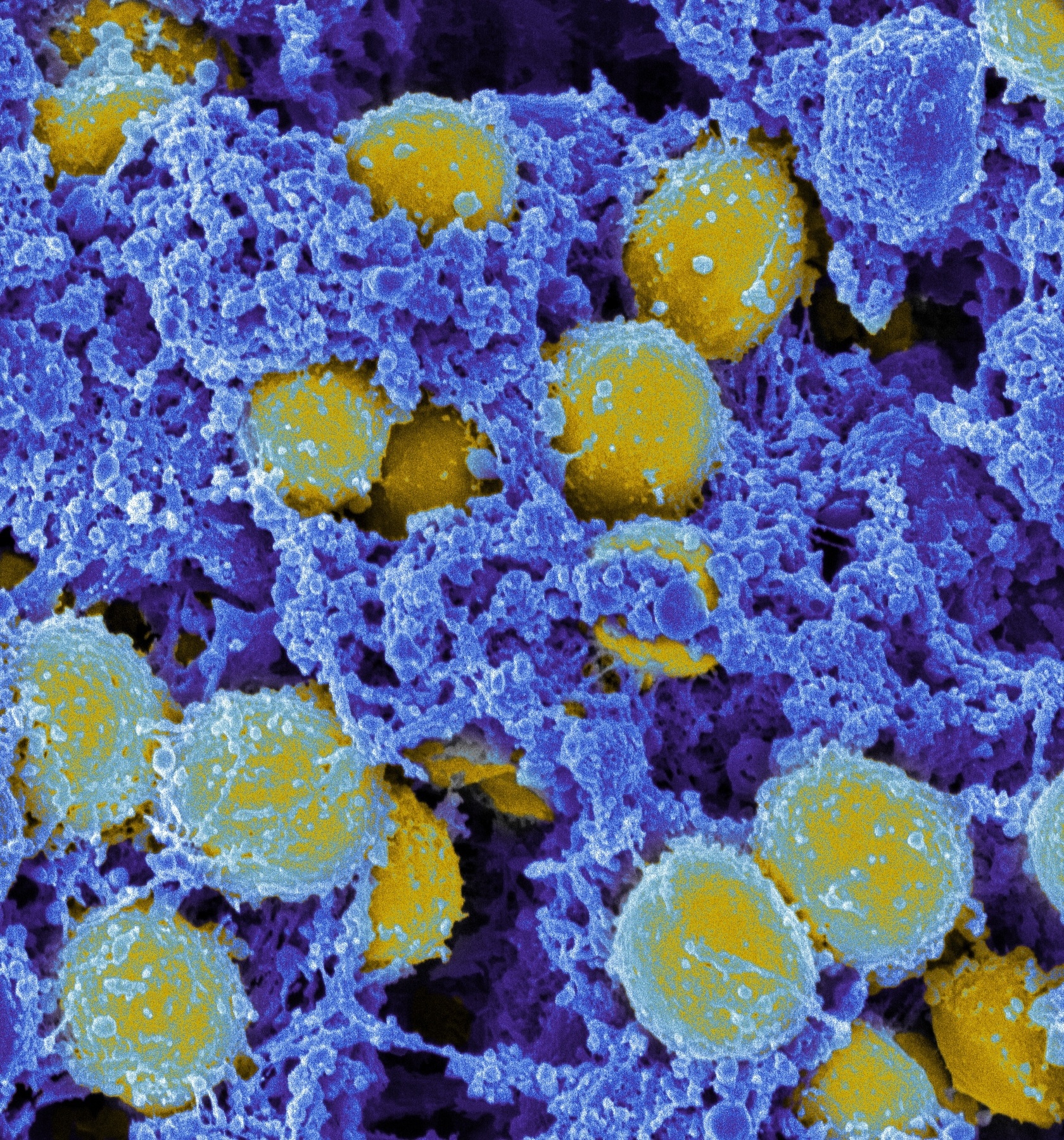 Rasterelektronenmikroskopische Aufnahme von S. aureus (gelb). Quelle: "Staphylococcus aureus Bacteria" von NIAID, lizenziert durch CC BY 2.0. (https://creativecommons.org/licenses/by/2.0/)
Rasterelektronenmikroskopische Aufnahme von S. aureus (gelb). Quelle: "Staphylococcus aureus Bacteria" von NIAID, lizenziert durch CC BY 2.0. (https://creativecommons.org/licenses/by/2.0/)Aktuell kann PhARIS ausschließlich Viren gegen S. aureus-Erreger analysieren. Mit entsprechendem Datenmaterial ist eine Adaption an andere Bakterien aber potenziell machbar. Dabei steht vor allem die Gruppe der multiresistenten ESKAPE-Erreger als Verursacher von im Krankenhaus erworbenen Infektionen im Vordergrund.6)
Peschel stellt allerdings klar: „Phagentherapien werden Antibiotika nicht ersetzen, sondern nur ergänzend zum Einsatz kommen. Denn es handelt sich immer um eine aufwendige individuelle Behandlung, da vorab sowohl der Subtyp des Erregers als auch der passende Phage identifiziert werden müssen. Prinzipiell ist die Strategie aber sehr gut, denn die Viren verschwinden nach Vernichtung des pathogenen Bakteriums wieder, da sie sich nicht weiter vermehren können.“
Insbesondere eine prophylaktische Behandlung von Risikopatienten, beispielsweise vor einem geplanten chirurgischen Eingriff, können sich die Forschenden gut vorstellen. Alle ESKAPE-Erreger finden sich im normalen Mikrobiom des Menschen, vor allem in der Nase und auf der Haut. Eliminiert man diese gezielt, bevor sie aufgrund des geschwächten Zustands im Zuge einer medizinischen Behandlung pathogen werden können, lässt sich die Gefahr schwerer Infektionen deutlich reduzieren.
Mit PhARIS haben die Forschenden jetzt einen wichtigen Beitrag geleistet, um auf dem Weg zur Bekämpfung von antibiotikaresistenten Erregern voranzukommen. „Wir sind aber keine Mediziner, die konkrete Anwendung liegt in der Hand der Ärztinnen und Ärzte.“