Theranostik von Prostatakrebs: die Verbindung von Radionuklid-Diagnostik und Radionuklid-Therapie
Mit einem von Heidelberger Forschenden entwickelten, schwach strahlenden Radiopharmakon, das an das prostataspezifische Membranantigen (PSMA) bindet, können mit der Positronen-Emissions-Tomografie/Computertomografie selbst kleine Metastasen von Prostatakrebs sichtbar gemacht werden. Dieses Radionuklid-Diagnostikum wurde modifiziert, mit einem starken Strahler gekoppelt und als therapeutischer Tracer eingesetzt, um die Krebszellen von innen heraus zu zerstrahlen.
Das Prostatakarzinom ist in Deutschland mit über 60.000 Neuerkrankungen jährlich bei Männern die häufigste Krebserkrankung und mit etwa 15.000 Todesfällen – nach Lungenkrebs – die zweithäufigste Krebstodesursache (Stand 2020). Die Sterblichkeit hängt davon ab, ob der Krebs frühzeitig erkannt und behandelt worden ist, bevor er Fernmetastasen gebildet hat. Bei fortgeschrittenen metastasierten Prostatakarzinomen beträgt die Überlebensrate fünf Jahre nach der Diagnosestellung nur etwa 30 Prozent.
Ein neues Radiopharmakon zur besseren Erkennung von Prostatakrebs
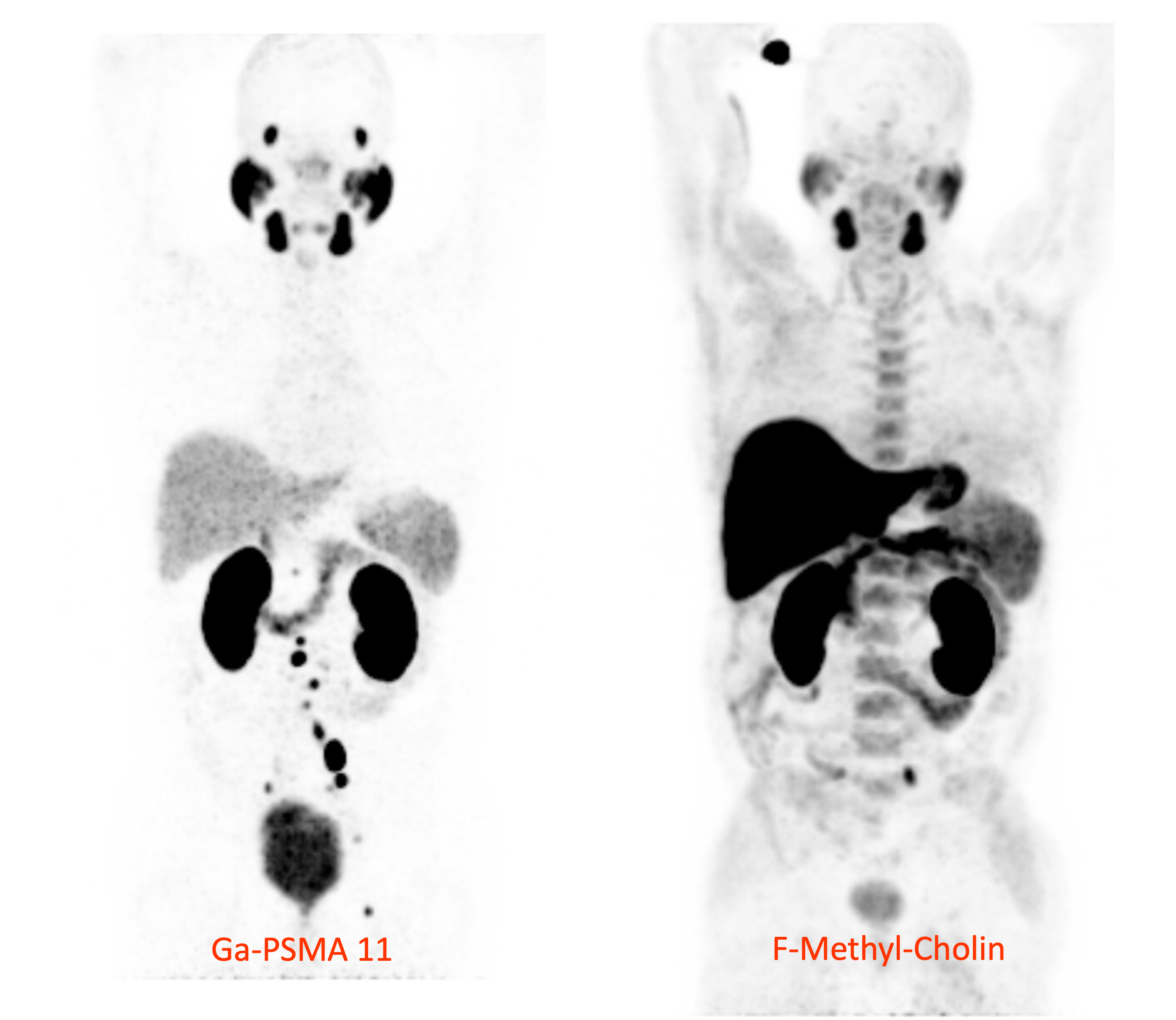 Mit der 68Ga-PSMA-PET-Methode können deutlich mehr Lymphknotenmetastasen des Prostatakarzinoms erkannt werden als mit der bisher üblichen 18F-Cholin-PET-Methode. © U. Haberkorn, Universitätsklinikum Heidelberg
Mit der 68Ga-PSMA-PET-Methode können deutlich mehr Lymphknotenmetastasen des Prostatakarzinoms erkannt werden als mit der bisher üblichen 18F-Cholin-PET-Methode. © U. Haberkorn, Universitätsklinikum HeidelbergUm Prostatakrebs und seine Metastasen zu diagnostizieren, entwickelte das Team des Chemikers Prof. Dr. Michael Eisenhut, inzwischen emeritierter Leiter der Abteilung Radiopharmazeutische Chemie am Deutschen Krebsforschungszentrum (DKFZ) Heidelberg, 2009/2010 ein Molekül, das an das prostataspezifische Membranantigen (PSMA) bindet und später PSMA-11 genannt wurde. Dieser synthetische Ligand wurde mit dem Radionuklid Gallium-68 (68Ga) zu einem Tracermolekül für die diagnostische Bildgebung durch Positronen-Emissions-Tomografie/Computertomografie (PET/CT) gekoppelt. PSMA ist ein Glykoprotein auf der Oberfläche von Prostataepithelzellen, das in allen Stadien des Prostatakarzinoms hochreguliert ist. Es kommt auf den Krebszellen hundert- bis tausendfach vervielfältigt vor; auf anderen Körperzellen ist PSMA kaum nachzuweisen. Der PET-Tracer [68Ga]Ga-PSMA-11 wird in die Blutbahn injiziert, von PSMA auf der Oberfläche der Krebszellen gebunden und in die Zellen aufgenommen. Mit nicht-invasiver nuklearmedizinischer PET-Bildgebung wird die durch den Positronenzerfall von 68Ga erzeugte Gammastrahlung in den Zellen lokalisiert.
 Prof. Dr. Uwe Haberkorn, Ärztlicher Direktor der Abteilung Nuklearmedizin der Radiologischen Universitätsklinik Heidelberg, Leiter der Klinischen Kooperationseinheit Nuklearmedizin am Deutschen Krebsforschungszentrum, Heidelberg. © U. Haberkorn
Prof. Dr. Uwe Haberkorn, Ärztlicher Direktor der Abteilung Nuklearmedizin der Radiologischen Universitätsklinik Heidelberg, Leiter der Klinischen Kooperationseinheit Nuklearmedizin am Deutschen Krebsforschungszentrum, Heidelberg. © U. HaberkornAn der Entwicklung für die Radionuklid-Diagnostik waren am DKFZ vor allem die Doktorandin Martina Benesova (jetzt Leiterin der DKFZ-Bayer-Nachwuchsgruppe Molekularbiologie Systemischer Radiotherapie), der Postdoc Dr. Matthias Eder (jetzt Professor am Universitätsklinikum Freiburg) und der Chemieingenieur Martin Schäfer beteiligt. Die präklinischen Tierexperimente wurden im Team des Nuklearmediziners Prof. Dr. Uwe Haberkorn an der Radiologischen Universitätsklinik Heidelberg durchgeführt. Bereits im Mai 2011 führte Haberkorn den PET-Tracer in die Klinik ein und erprobte ihn erstmals an einzelnen Patienten.
Am DKFZ übernahm dann Prof. Dr. Klaus Kopka als Eisenhuts Nachfolger gemeinsam mit seinem Team die Weiterentwicklung von [68Ga]Ga-PSMA-11 für die molekulare Bildgebung. Kopka, seit 2019 Direktor des Instituts für Radiopharmazeutische Krebsforschung Dresden, beschreibt die Untersuchungsergebnisse einer vom Deutschen Konsortium für Translationale Krebsforschung finanzierten Klinischen Studie mit dem PET-Tracer bei Patienten mit hohem Risiko für ein Prostatakarzinom als spektakulär: „Damit werden selbst kleine Metastasen im Körper des Patienten sichtbar gemacht, die auch mit der besten Computertomografie oder Magnetresonanztomografie kaum nachweisbar gewesen wären.“ Die Aufnahmen der Krebsmetastasen waren wesentlich sensitiver als mit der zuvor als Goldstandard dienenden 18F-Cholin-PET-Diagnostik. Haberkorn erinnert sich: „Auf einmal sagten mir die Strahlentherapeuten und Urologen, dass sie für die Diagnostik nur noch mit diesem neuen Wirkstoff arbeiten wollen.“ Inzwischen wurde die neue Methode bereits bei Hunderttausenden Patienten weltweit eingesetzt.
Entwicklung eines therapeutischen Tracers
 Prof. Dr. Klaus Kopka, seit 2019 Direktor des Instituts für Radiopharmazeutische Krebsforschung, Helmholtz-Zentrum Dresden-Rossendorf (zuvor DKFZ, Heidelberg). © K. Kopka
Prof. Dr. Klaus Kopka, seit 2019 Direktor des Instituts für Radiopharmazeutische Krebsforschung, Helmholtz-Zentrum Dresden-Rossendorf (zuvor DKFZ, Heidelberg). © K. KopkaDie Eigenschaft des Tracers, selektiv von PSMA-tragenden Tumorzellen aufgenommen zu werden, veranlasste die Forschenden an DKFZ und Universitätsklinikum Heidelberg, das Radionuklid-Diagnostikum zu einem Radionuklid-Therapeutikum zu transformieren, das durch seine Strahlung die Krebszellen nicht nur sichtbar macht, sondern sie von innen heraus zerstört. Die neue Variante des PSMA-11-Moleküls wurde mit einem Radionuklid ausgestattet, das harte, zerstörerische Strahlung von kurzer Reichweite aussendet. So entstand der therapeutische Tracer PSMA-617, der mit dem Lutetium-Isotop 177Lu, einem Betastrahler, gekoppelt ist. Da die radioaktive Strahlung nur wenige Millimeter weit reicht und der Wirkstoff rasch aus dem Blutstrom entfernt und ausgeschieden wird, bleibt die zerstörerische Wirkung weitgehend auf die Krebszellen beschränkt, an die er bindet. Das umliegende Gewebe wird somit geschont. Als man bei individuellen Heilversuchen Patienten mit zahlreichen Metastasen im ganzen Körper, die auf andere Therapien nicht mehr ansprachen, mit dem neuen Wirkstoff [177Lu]Lu-PSMA-617 behandelte, übertrafen die Ergebnisse die Erwartungen: Hatten die Patienten vor der Behandlung im besten Fall noch eine Lebenserwartung von wenigen Monaten gehabt, so konnten sie nun in Einzelfällen viele Monate bis Jahre überleben.
Das Theranostik-Konzept
Für ihre interdisziplinäre Entwicklung einer Radionuklid-Diagnostik, verbunden mit Radionuklid-Therapie, wurden die Chemiker Eisenhut und Kopka, der Nuklearmediziner Haberkorn und der Biotechnologe Eder 2018 gemeinsam mit dem Erwin-Schrödinger-Preis ausgezeichnet, den der Stifterverband der Helmholtz-Gemeinschaft Deutscher Forschungszentren für innovative Leistungen in Grenzgebieten der Medizin, Natur- und Ingenieurwissenschaften jährlich vergibt.
Die enge Verzahnung von Diagnostik und Therapie, wie sie sich bei der PSMA-11/PSMA-617-Behandlung zeigt, wird als Theranostik (auch: Theragnostik) bezeichnet, ein Konzept, auf das – gerade auch in der Radionuklid-Therapie – große Hoffnungen gesetzt werden. Prinzipiell können spezifische Moleküle auch gegen andere Tumormarker entwickelt und diese an unterschiedliche Strahler gekoppelt werden. Haberkorn und seine Kollegen haben mittlerweile ihre Arbeiten an einer Tracerklasse abgeschlossen, die das Protein FAP (Fibroblasten-Aktivierungs-Protein) erkennt. FAP kommt stark vervielfältigt bei vielen menschlichen Krebsarten in fortgeschrittenem Stadium auf der Oberfläche der mit den Tumoren assoziierten Bindegewebszellen vor. In einem kürzlich publizierten Review wurde es als „potential novel molecule of the century“ bezeichnet (Frontiers in Oncology, May 2022) und wird bereits an vielen Standorten in der Klinik erprobt.
Zulassung von [177Lu]Lu-PSMA-617 für die Endoradiotherapie
Das DKFZ hatte den Wirkstoffkandidaten [177Lu]Lu-PSMA-617 für die präklinische Entwicklung exklusiv an die ABX GmbH in Radeberg auslizenziert. 2017 erwarb das US-amerikanische Unternehmen Endocyte Inc. die Lizenzrechte und begann mit einer Klinischen Phase III-Studie (VISION Trial) für die Zulassung als Radionuklid-Therapeutikum gegen fortgeschrittenen Prostatakrebs. Ende 2018 wurde Endocyte für 2,1 Mrd. US-Dollar von Novartis übernommen. Wie es hieß, traut der Schweizer Pharmariese dem Wirkstoff einen Jahresumsatz von mehr als 1 Mrd. zu. Ende März 2022 erteilte die amerikanische Arzneimittelbehörde FDA dem Medikament unter dem Namen PluvictoTM die Zulassung zur Behandlung von metastasiertem (als „kastrationsresistent“ bezeichneten) Prostatakarzinom bei Männern, die bereits eine Chemotherapie und Hormonentzugstherapie erhalten hatten. Außerdem muss nachgewiesen sein, dass PSMA auf den Krebszellen vorhanden ist – das ist bei etwa 80 bis 90 Prozent der Krebspatienten der Fall. Auf die Nachricht hin sagte Prof. Dr. Michael Baumann, Vorstandsvorsitzender des DKFZ: „Die FDA-Zulassung ist eine große Chance für die betroffenen Männer. Von dem neuen Medikament können jetzt weltweit Patienten mit fortgeschrittenem Prostatakrebs profitieren, die sonst kaum noch aussichtsreiche Behandlungsoptionen haben.“ Mit einer Zulassung durch die Europäische Arzneimittelbehörde EMA wird in Kürze gerechnet.