Makrophagen im Zusammenspiel mit Zytomegalieviren
Umsturz der Makrophagen-Identität durch Zytomegalieviren
Im Grunde sind Zytomegalieviren harmlos. Treten sie jedoch zusammen mit anderen Erregern auf, können sie schwerwiegende Erkrankungen auslösen. Sie sind in der Lage, unser Immunsystem zu manipulieren und eigentlich sesshafte Abwehrzellen zum Wandern zu animieren. Die Leidtragenden sind Immungeschwächte und Ungeborene im Mutterleib. Forschende am Centrum für Chronische Immundefizienz (CCI) der Uniklinik Freiburg haben herausgefunden, welche Mechanismen der Verhaltensveränderung bei Makrophagen zugrunde liegen, die anderen Erregern den Angriff erleichtern.
Zytomegalieviren (CMV) zählen zu den humanen Herpesviren und sind weltweit verbreitet. Seit Jahrmillionen haben sie sich mit der menschlichen Spezies entwickelt und gehören quasi zum Menschen dazu. Es wird davon ausgegangen, dass heute etwa die Hälfte der deutschen Bevölkerung das Virus in sich trägt. Der Kinderarzt und Immunologe Prof. Dr. Philipp Henneke hat die Infektionsmechanismen der Zytomegalieviren untersucht und weiß, dass sie bei gesunder Immunabwehr nicht krank machen: „Es gibt eine extreme Anpassung zwischen Virus und Mensch, was sich schon in der starken Spezialisierung des Virus auf den Menschen als Wirt zeigt“, sagt er. „Menschliche Zytomegalieviren können nur Menschen infizieren.“ Die Ansteckung erfolgt in engem Körperkontakt über sämtliche Körperflüssigkeiten wie Speichel, Blut und insbesondere Muttermilch. Dabei dringt das Virus über den Darm und die Lunge per Schmier- oder Tröpfcheninfektion ein.
Abwechselnde Phasen von Latenz und produktiver Infektion
 Prof. Dr. Philipp Henneke hat herausgefunden, wie Makrophagen von Zytomegalieviren manipuliert werden, um die Virenverbreitung zu gewährleisten. © bz Freiburg
Prof. Dr. Philipp Henneke hat herausgefunden, wie Makrophagen von Zytomegalieviren manipuliert werden, um die Virenverbreitung zu gewährleisten. © bz FreiburgDie Erstinfektion verläuft in der Regel asymptomatisch oder geht nur mit leichteren grippeartigen Beschwerden wie Husten und Fieber einher. Dennoch führt sie zu lebenslanger Persistenz des Erregers im Körper. „Es ist typisch für alle Herpesviren, dass sie eine sogenannte Latenz entwickeln“, erklärt Henneke. „Man merkt nicht, dass man sie im Körper hat. Wenn sich jedoch die Immunitätslage verändert, dann können sie sich wieder vermehren.“
Normalerweise ist eine Behandlung einer Zytomegalieinfektion nicht nötig, denn sie klingt meist von alleine ab. Ist ein Immunsystem aber noch nicht ausgereift oder geschwächt, kann das CMV aktiv werden. Innerhalb der ersten drei Monate einer Schwangerschaft ist das Risiko nach Erstkontakt der Mutter mit dem Virus besonders hoch für Fruchtschäden oder Fehlgeburt des Kindes. Neugeborene, die sich im Mutterleib infiziert haben, können Wachstumsstörungen und neurologische Schäden sowie eine Hörstörung entwickeln. Das Zytomegalievirus ist die häufigste Ursache erworbener Taubheit.
Besteht allerdings vor der Schwangerschaft eine Immunität der Mutter, ist das Baby normalerweise nicht gefährdet. Auch ab dem Zeitpunkt der Geburt ist die Infektion nur selten problematisch. Bei immunologisch geschwächten Menschen kann sie jedoch zu schweren Erkrankungen führen. Das gilt etwa für Patientinnen und Patienten, deren Immunsystem bereits durch ein Tumorleiden, HIV oder eine Organtransplantation gehemmt ist. „Hier spielen Zytomegalieviren eine große Rolle, und Betroffene können wirklich schwer erkranken“, meint der Immunologe. Das Virus kann verschiedene Gewebe wie Leber, Darm, Netzhaut und Nervensystem infizieren, aber am häufigsten ist die Lunge betroffen. Die bisherigen Therapien mit antiviralen Mitteln können die Infektion nur eindämmen, das Virus jedoch nicht vollständig zerstören.
Veränderung von Phänotyp und Funktion
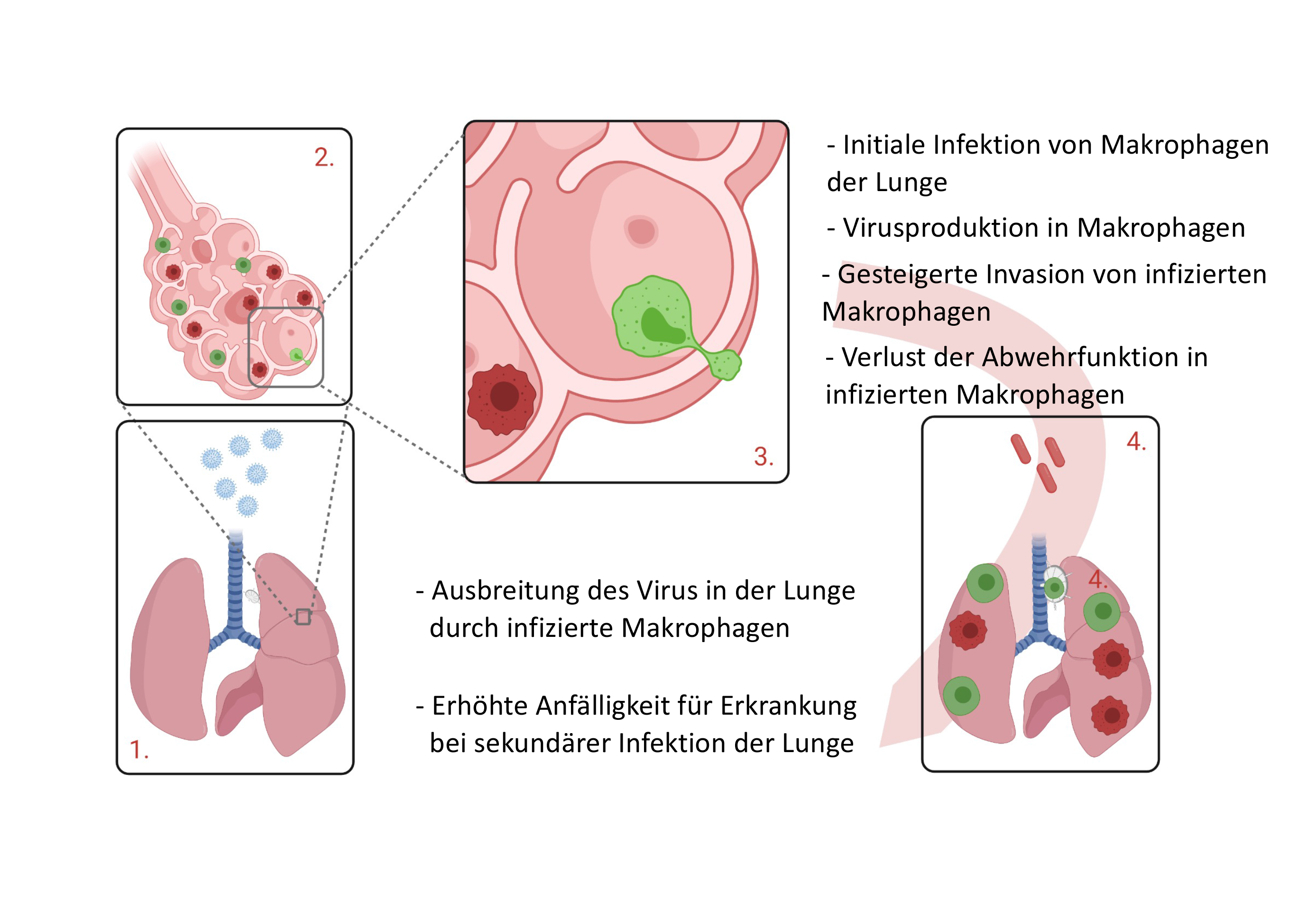 Nachdem die Zytomegalieviren in die Lunge eingedrungen sind, werden gesunde Makrophagen (dunkelrot) infiziert, welche dann als CMV-Makrophagen (grün) die weitere Verbreitung in Lunge und Lymphknoten vorantreiben. © Prof. Dr. Philipp Henneke, Uniklinik Freiburg
Nachdem die Zytomegalieviren in die Lunge eingedrungen sind, werden gesunde Makrophagen (dunkelrot) infiziert, welche dann als CMV-Makrophagen (grün) die weitere Verbreitung in Lunge und Lymphknoten vorantreiben. © Prof. Dr. Philipp Henneke, Uniklinik FreiburgDie ersten Abwehrzellen, die bei Tröpfcheninfektion in Kontakt mit CMV kommen, sind die Alveolar-Makrophagen in der Lunge. Diese spezialisierten Fresszellen sitzen in den kleinen Lungenbläschen (Alveolen). Wenn Allergene oder Mikroorganismen in die Lunge gelangen, werden die Alveolar-Makrophagen aktiv, fressen diese winzigen Fremdkörper mittels Phagozytose und übernehmen so die erste Immunabwehr des Lungengewebes. Dringt eine größere Zahl von Mikroorganismen ein, so geben Alveolar-Makrophagen zusätzlich Botenstoffe in Form von Zytokinen ab, die andere Immunzellen wie neutrophile Granulozyten anlocken und somit eine Entzündungsreaktion auslösen. „Wir wissen, dass ein einzelner Alveolar-Makrophage für drei Lungenbläschen zuständig ist“, sagt Henneke. „Diese Zellen bewegen sich zuverlässig nur in ihrem Territorium von Lungenbläschen.“
Wenn CMV nun über die Lunge in den Körper gelangt und Makrophagen infiziert, „dann werden diese von dem Virus völlig verändert“, so der Wissenschaftler. „Die sonst residenten Zellen verlassen ihren Platz, bewegen sich wesentlich schneller und dringen ins Gewebe ein.“ Dadurch verteilen die infizierten Makrophagen die Viren in weit entfernte Bereiche der Lunge und in benachbarte Lymphknoten, scheinbar ohne wesentliche Reaktion des Körpers. Sie verlieren ihre Fähigkeit zur Phagozytose und Zytokinproduktion und sehen auch nicht mehr wie Makrophagen aus. Die Zytomegalieviren haben sie völlig umprogrammiert.
Eine Art Tarnkappe für die Makrophagen
Gemeinsam mit Sebastian Baasch, Dr. Zsolt Ruzsic und ihrem Team am Centrum für Chronische Immundefizienz (CCI) der Uniklinik Freiburg konnte Henneke zeigen, dass die Makrophagen von den Zytomegalieviren in Virusfabriken umgebaut werden, indem sie eine morphologische und metabolische Transformation durchlaufen und die Zellmaschinerie in Richtung der Virusbedürfnisse verschoben wird.
Aber wie ist das möglich? Normalerweise gilt diese Art der Immunzellen als vollständig differenziert. Sie können sich also nicht mehr wesentlich in ihren Funktionen verändern, auch wenn eine gewisse Variabilität oder Plastizität die Bewältigung von neuen Herausforderungen erlaubt. Die neu entdeckten Veränderungen der CMV-infizierten Makrophagen überstiegen jedoch das bekannte Maß der Plastizität bei weitem. Vorher etablierte Grenzen wurden so stark ausgedehnt, dass ein neuer Zellstatus entstand. Demnach ist CMV fähig, in die Zellmaschinerie des Makrophagen derart einzugreifen, dass die Zelldifferenzierung quasi zurückgedreht wird. Es entsteht eine Zelle, die wieder Eigenschaften einer Stammzelle besitzt und makrophagenspezifische Merkmale verloren hat. Das hat zur Folge, dass sie ihre Abwehrfunktion nicht mehr ausüben kann und der Weg für Sekundärinfektionen, beispielsweise mit Bakterien, geebnet ist.
„Die Zytomegalieviren verändern das Immunsystem für sich selbst, damit sie sich gut verbreiten können, aber sie verändern es natürlich auch in der Abwehr gegenüber anderen Erregern, wenn sie zeitgleich mit ihnen auftreten“, meint Henneke. Er und sein Team führten kinetische Analysen von Transkriptom und Proteom der Makrophagen durch. „Sogar mit molekularen Methoden konnten wir sie nicht mehr als Makrophagen erkennen, so sehr haben sie sich verändert“, resümiert er. Die für Alveolar-Makrophagen charakteristischen Gen-Sets konnten nicht mehr gefunden werden, und die typischen Oberflächenmarker auf der Zelle waren herunterreguliert. Stattdessen fanden sie hochregulierte Gene, die für die Erhaltung von Stammzelleigenschaften codieren. So, als hätten sie den Makrophagen eine Art Tarnkappe aufgesetzt.
Wnt-Signalweg als Herzstück der Transformation
Offenbar greift CMV direkt in Differenzierungsprozesse ein, indem es einen bestimmten Signalweg anvisiert. Den Freiburger Forschenden ist es gelungen, den Transkriptionsfaktor ZEB1 in den infizierten Zellen auszumachen. ZEB1 induziert einen Signalweg, der für die Transformation der Makrophagen mit verantwortlich ist. Dieser sogenannte Wnt-Signalweg (Wingless + Int-1) verursacht in den infizierten Makrophagen die erhöhte Mobilität und Invasivität. Wnt ist außerdem essenziell für eine normale Embryogenese im Mutterleib, einer Lebensphase, in der tatsächlich noch viele Zellen mobil sein und ihren definierten Platz finden müssen. Aber auch in bestimmten Krebsformen wurde der Signalweg gefunden, in denen sich die Invasivität in Form von Metastasierung zeigen kann. Darüber hinaus können Makrophagen, die von CMV reprogrammiert wurden, an der Entstehung von Brustkrebs beteiligt sein, da in Tumorgewebe oft Zytomegalieviren enthalten sind.
Henneke und sein Team haben mit Wnt nun einen Angriffspunkt, mit dem sie gezielt Therapien für immungeschwächte Menschen, etwa nach einer Organtransplantation, entwickeln können. Blockiert man den Transkriptionsfaktor Zeb1 in vitro, kann man die CMV-induzierte Invasivität der Makrophagen verhindern. Wie es sich in vivo verhält, wird die weitere Forschung zeigen.