Hirntumorpatienten könnten von Schwerionentherapie profitieren
Das Glioblastom ist ein bösartiger Hirntumor. Er spricht viel schlechter auf konventionelle Therapieformen an als andere Tumoren, da er auch besonders widerstandsfähige Krebszellen enthält. Dass die Schwerionentherapie etwas gegen diese Zellen ausrichten kann, zeigten Wissenschaftler des Heidelberger Ionenstrahl-Therapiezentrums (HIT) am Universitätsklinikum Heidelberg und des Deutschen Krebsforschungszentrums.
 Prof. Dr. med. Dr. rer. nat. Jürgen Debus, Wissenschaftlich-medizinischer Leiter des HIT © Universitätsklinikum Heidelberg
Prof. Dr. med. Dr. rer. nat. Jürgen Debus, Wissenschaftlich-medizinischer Leiter des HIT © Universitätsklinikum HeidelbergDas Glioblastom ist der häufigste bösartige Hirntumor bei Erwachsenen. Es wird mit einigen weiteren Krebsarten des Gehirns zu den Gliomen gezählt, die sich aus den sogenannten Gliazellen, den Stützzellen des Gehirns entwickeln. Statistisch gesehen kommt die Erkrankung relativ selten vor. In Deutschland wurden im Jahr 2014 etwa 4.500 Glioblastome diagnostiziert, was etwa ein Prozent aller Krebsneuerkrankungen ausmacht. Die Erkrankung kann in jedem Lebensalter auftreten. „Wir haben sehr junge Patienten im Alter von zwei oder drei Jahren bis zum betagten 90-Jährigen“, sagt Prof. Dr. med. Dr. rer. nat. Jürgen Debus, wissenschaftlich-medizinischer Leiter des Heidelberger Ionenstrahl-Therapiezentrums (HIT) am Universitätsklinikum Heidelberg.
Unbehandelt liegt die mittlere Überlebensrate nach einer Glioblastom-Diagnose bei drei bis vier Monaten. Die mittlere Überlebensrate gibt an, wie lange 50 von 100 Patienten weiterleben. „Mit gängigen Therapieformen liegt sie bei 18 Monaten“, sagt Debus. „Aber es ist schwierig in Wahrscheinlichkeiten zu sprechen. Die Therapie hat sich in den letzten Jahren speziell in molekular definierten Subgruppen verbessert, sodass heute ein Teil der Patienten zwei bis drei Jahre überlebt und in dieser Erkrankung als Langzeitüberlebender gilt.“ Das Alter spielt dabei eine große Rolle: Jüngere Patienten überleben in der Regel länger als ältere. Heilbar ist ein Glioblastom selten und über 90 Prozent der Patienten sterben innerhalb von fünf Jahren nach der Diagnose an der Krankheit.
Tumorstammzellen reparieren Schäden am Erbgut
Das Glioblastom wird heute in einer kombinierten Therapie behandelt. Zunächst wird der Tumor operativ entfernt. Da immer einzelne Tumorzellen in das gesunde Gewebe einwandern und nicht entfernt werden können, folgen Bestrahlung und Chemotherapie. „Lange hat man sich die Frage gestellt, warum Hirngewebe, das nur ein beschränktes regeneratives Potenzial besitzt, einen Tumor hervorbringt, der so aggressiv wächst“, meint Debus. Inzwischen wissen die Forscher, dass es im Glioblastom Zellen mit Stammzelleigenschaften gibt, die Schäden reparieren und aus denen sich der Tumor immer wieder neu regenerieren kann.
In der herkömmlichen Strahlentherapie wird mit Röntgen- oder Gammastrahlen gearbeitet, die aus kleinen Energiepaketen, den sogenannten Photonen, bestehen. Sie ist in einer Gewebetiefe von bis zu drei Zentimetern am wirksamsten. Danach fällt die Dosis ab, weil der Strahl auf seinem Weg durch das Gewebe abgeschwächt wird. Die Photonen erzeugen in den Zellen reaktive Sauerstoffmoleküle, die das Erbgut der Krebszellen schädigen. Allerdings reagiert das Glioblastom viel schlechter auf diese Art der Bestrahlung als andere Tumoren: Zum einen können Tumorstammzellen die reaktiven Sauerstoffmoleküle neutralisieren und Schäden am Erbgut reparieren. Zum anderen herrscht im schlecht durchbluteten Inneren des Tumors Sauerstoffmangel (Hypoxie), sodass weniger reaktive Sauerstoffmoleküle entstehen und somit auch die dort vorkommenden hypoxischen Zellen die Bestrahlung überstehen. Tumorgefäße und andere Tumorzellen werden durch die Bestrahlung zerstört, was zu einer Art Selektionsdruck führt, sodass verstärkt hypoxische Zellen entstehen, die zudem Substanzen abgeben, die die Immunabwehr schwächen.
Kohlenstoffionen sind biologisch wirksamer
 Bestrahlungsraum mit einer um 360° drehbaren Bestrahlungsquelle, der sogenannten Gantry. So kann der Ionenstrahl aus jeder Richtung auf den Tumor gelenkt werden. Es gibt am HIT noch zwei weitere Behandlungsplätze mit fester horizontaler Strahlführung. © Universitätsklinikum Heidelberg
Bestrahlungsraum mit einer um 360° drehbaren Bestrahlungsquelle, der sogenannten Gantry. So kann der Ionenstrahl aus jeder Richtung auf den Tumor gelenkt werden. Es gibt am HIT noch zwei weitere Behandlungsplätze mit fester horizontaler Strahlführung. © Universitätsklinikum HeidelbergBei der Schwerionentherapie wird der Tumor mit positiv geladenen Kernen von Kohlenstoff-, Sauerstoff- oder Heliumatomen bestrahlt. In der vorliegenden Studie wurde an Zellkulturen und Mausmodellen untersucht, wie das Glioblastom auf die Bestrahlung mit Kohlenstoff-Ionen reagiert. Dabei werden die geladenen Teilchen auf über drei Viertel der Lichtgeschwindigkeit beschleunigt. Sie legen also ungefähr 225.000 Kilometer pro Sekunde zurück. Sie können bis zu 30 Zentimeter tief ins Gewebe eindringen und werden dabei kaum abgeschwächt, sodass der wesentliche Teil der Energie an das Tumorgewebe abgegeben wird. Bei dieser Art der Bestrahlung sind es die Kohlenstoff-Ionen selbst, die am Erbgut Schäden verursachen. Diese können Tumorstammzellen und hypoxische Zellen nicht reparieren. Durch die Vernichtung der hypoxischen Zellen verändert sich zudem das Tumormilieu: Die Wissenschaftler konnten zeigen, dass sich die Komposition des Immunsystems günstig verändert und im Vergleich zur konventionellen Bestrahlung weniger Immunabwehr-schwächende Zellen an den Tumor gelangen. Somit könnte das Glioblastom eventuell auch für Immuntherapien zugänglich gemacht werden, die bei verschiedenen anderen Krebsarten bereits erfolgreich sind.
Beschwerden sind bei dem bösartigen Hirntumor zunächst unspezifisch. „Diffuse Kopfschmerzen, verminderte Leistungsfähigkeit, Merkfähigkeitsstörung oder Schwindel“, zählt Debus auf, „das hängt stark davon ab, wo das Glioblastom wächst.“ Weiterhin kann ein Tumor zu halbseitigen Lähmungen oder epileptischen Anfällen führen. Es gibt keine Lebensgewohnheiten oder beeinflussbare Risiken, die die Wahrscheinlichkeit erhöhen an einem Glioblastom zu erkranken. „Die Patienten haben an der Stelle nichts „falsch“ gemacht“, sagt Debus. Lediglich ein Faktor lässt sich in Zusammenhang mit der Erkrankung bringen: Eine therapeutische Strahlenbehandlung kann das Risiko für eine Erkrankung geringfügig steigern. „Von 100 am Hirn mit höherer Dosis bestrahlten Patienten entwickeln zwei bis drei ein Glioblastom“, so Debus. Rein statistisch dauert es sehr lange, bis sich dieses Risiko auswirkt. Daher ist es vor allem für Kinder und Jugendliche relevant.
Forschungsergebnisse sollen auf Patienten übertragen werden
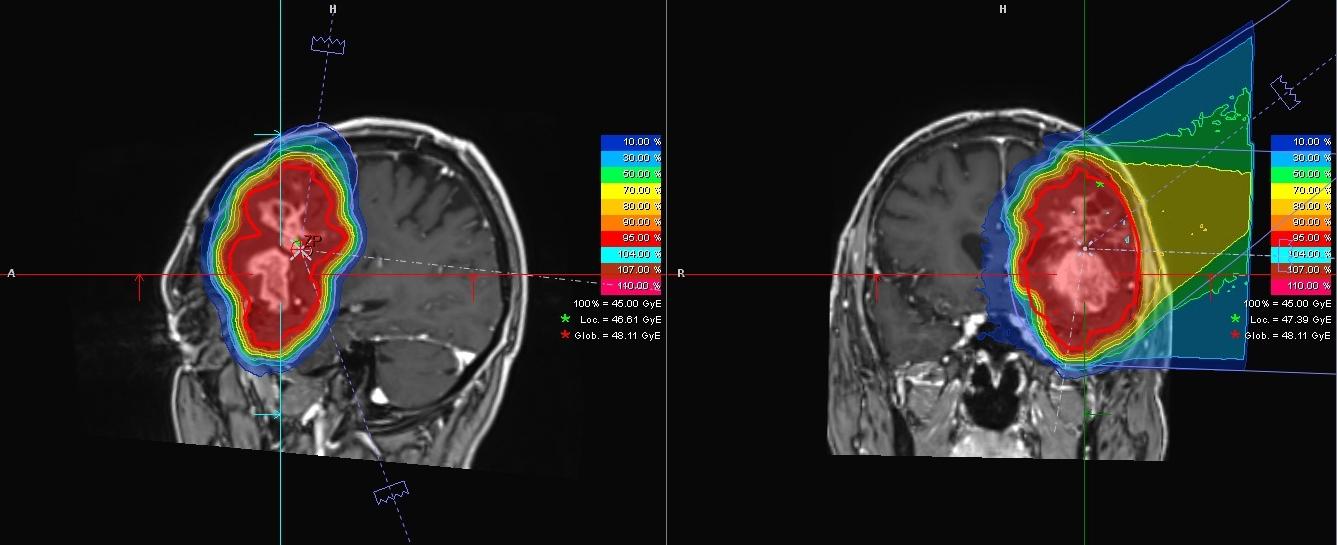 Die Aufnahmen zeigen das Glioblastom eines 55-jährigen Patienten in der Nähe der linken Schläfe. Der Tumor wurde mittels Magnetresonanztomographie (MRT) aus verschiedenen Perspektiven aufgenommen. Die Farben zeigen die Verteilung der geplanten Strahlendosis: Im Bereich des Tumors ist sie am höchsten (rot), mit zunehmender Entfernung zum Tumor wird sie immer niedriger. © Universitätsklinikum Heidelberg
Die Aufnahmen zeigen das Glioblastom eines 55-jährigen Patienten in der Nähe der linken Schläfe. Der Tumor wurde mittels Magnetresonanztomographie (MRT) aus verschiedenen Perspektiven aufgenommen. Die Farben zeigen die Verteilung der geplanten Strahlendosis: Im Bereich des Tumors ist sie am höchsten (rot), mit zunehmender Entfernung zum Tumor wird sie immer niedriger. © Universitätsklinikum HeidelbergDie Schwerionentherapie kann auch unerwünschte Nebenwirkungen haben. Denn häufig sind Tumorgewebe und gesundes Gewebe miteinander vermischt, wobei das gesunde Gewebe einwandfrei funktioniert. „Es ist manchmal beeindruckend“, sagt Debus, „dass Patienten, die einen Tumor im Sprachzentrum haben, ganz normal sprechen können.“ Es kann dann sein, dass das gesunde Gewebe bei der Schwerionentherapie mitreagiert und geschädigt wird. „Es lässt sich keine generelle Aussage treffen“, erklärt Debus, „aber im Einzelfall kann man sagen, wie hoch die Wahrscheinlichkeit für bestimmte Nebenwirkungen ist.“
Die Forschungsergebnisse der vorliegenden Untersuchungen zur Schwerionentherapie bei Glioblastomen beziehen sich auf Zellkulturen und Mausmodelle. Aber das Team um Debus arbeitet daran, diese auf Patienten zu übertragen. Erste Daten aus einer Studie bei Rezidiv-Patienten mit hochgradigen Gliomen liegen vor. Ein Rezidiv ist ein Rückfall, es tritt also nach einer erfolgreichen Krebsbehandlung erneut ein Tumor am selben Ort auf. „Die ersten vergleichenden Studien in der Rezidivsituation zeigen einen potentiellen Vorteil der Kohlenstoffionentherapie gegenüber der Photonentherapie“, berichtet Debus, „das werden wir in randomisierten prospektiven Studien überprüfen.“