Projekt SolidCAR-T
Modulare „Minifabriken“ für die dezentrale Produktion von CAR-T-Zellen
Die vielversprechenden neuartigen CAR-T-Zelltherapien werden derzeit in der Behandlung von akuten Leukämien und Lymphomen eingesetzt. Im SolidCAR-T-Projekt wollen Forschende des Fraunhofer IPA in Stuttgart, des Universitätsklinikums Tübingen und des NMI in Reutlingen CAR-T-Zellen gegen solide Tumoren generieren und deren Produktion mithilfe von „Minifabriken“ automatisiert und somit deutlich kostengünstiger direkt vor Ort in der Klinik ermöglichen.
Bei der Behandlung von Krebserkrankungen kommen unterschiedliche Therapieansätze zur Anwendung. In erster Linie sind dies chirurgische Eingriffe, Chemotherapien oder Bestrahlungen. Darüber hinaus werden zunehmend immuntherapeutische Behandlungsstrategien eingesetzt, die das Immunsystem der Erkrankten zur Krebsbekämpfung nutzen. Diese neuartigen Ansätze zählen zu den Hoffnungsträgern der Medizin.
CAR-T-Zelltherapien beruhen auf der Funktion der körpereigenen T-Lymphozyten. Diese sind Bestandteil der spezifischen Immunabwehr und bekämpfen infizierte oder entartete Zellen im Körper. Bei der CAR-T-Zelltherapie werden die T-Lymphozyten der Patientinnen und Patienten gentechnisch so verändert, dass sie auf ihrer Oberfläche einen künstlichen Rezeptor, einen CAR (chimären Antigenrezeptor) ausbilden, mit dessen Hilfe sie sehr spezifisch Krebszellen erkennen und eliminieren können. Diese zielgerichtete Therapieform setzt eine molekulare Diagnostik des Tumors voraus, wie sie im Rahmen der Personalisierten Medizin durchgeführt wird. Sie zählt zu den Arzneimitteln für neuartige Therapien (ATMP, Advanced Therapy Medicinal Product), die nicht nur in der Onkologie neue Möglichkeiten eröffnen.
CAR-T-Zelltherapie: individuell und aufwendig
Seit 2018 sind in Deutschland zwei dieser CAR-T-Zelltherapien zugelassen. Beide richten sich gegen das CD19-Antigen, das auf B-Zellen vorkommt, und werden bei Leukämien und Lymphomen der B-Zell-Reihe eingesetzt. Ihre Herstellung ist aktuell stark manuell geprägt und durchläuft ein aufwendiges Verfahren: Körpereigene T-Lymphozyten werden den Erkrankten mittels Leukapherese (Abtrennung der weißen Blutkörperchen) entnommen, im Labor mithilfe von Lentiviren gentechnisch so verändert, dass sie den CAR auf der Oberfläche bilden und nach ihrer Vermehrung den Patientinnen und Patienten wieder zurückgegeben.
Eine der größten Herausforderungen im ATMP-Bereich sind die Qualitätsanforderungen an die Gen- und Zelltherapeutika und die damit verbundene Beschränkung der Entwicklung und Herstellung auf wenige Produktionszentren. Dies und die oft sehr langen Entwicklungszeiten und großen Entwicklungsrisiken sowie die aufwendigen Klinischen Studien führen zu sehr hohen Behandlungskosten – eine einzelne Dosis liegt derzeit bei ca. 275.000 Euro. Aus diesem Grund stehen die Therapien bislang nicht breitflächig zur Verfügung. Aufgrund der hohen Qualitätsanforderungen und der Abhängigkeit von einer produktspezifischen Herstellungserlaubnis gibt es für ATMPs bisher noch keine standardisierten Herstellverfahren, die die Produktionskosten erheblich senken würden.
„Minifabriken“ für die dezentrale Produktion
 Andreas Traube und Sarah Kleine-Wechelmann vom Fraunhofer IPA koordinieren das Projekt SolidCAR-T zur Entwicklung der „Minifabriken“. © Fraunhofer IPA
Andreas Traube und Sarah Kleine-Wechelmann vom Fraunhofer IPA koordinieren das Projekt SolidCAR-T zur Entwicklung der „Minifabriken“. © Fraunhofer IPAEin interdisziplinäres Konsortium aus dem Fraunhofer-Institut für Produktionstechnik und Automatisierung (IPA) in Stuttgart, dem Universitätsklinikum Tübingen (UKT) und dem Naturwissenschaftlichen und Medizinischen Institut (NMI) in Reutlingen will anhand einer ausgewählten Indikation, dem Gallengangkarzinom, die gesamte Entwicklungskette eines ATMPs abbilden: von der Herstellung der viralen Vektoren über die Prozessentwicklung und die Automatisierung des Herstellprozesses bis hin zu neuen In-vitro-Testverfahren für den Wirksamkeitsnachweis der produzierten Therapeutika sowie der Inline-Qualitätskontrolle. „Die Personalisierte Medizin erfordert neue Produktionsweisen. Wir glauben, es ist viel besser, wenn man dort produziert, wo auch die Patienten sind; nämlich dezentral in der Klinik“, erläutert Andreas Traube, Leiter der Abteilung Laborautomatisierung und Bioproduktionstechnik am Fraunhofer IPA und verantwortlich für die Automatisierung eines Teilprozesses im Projekt. Aus diesem Grund sollen in dem vom Ministerium für Wirtschaft, Arbeit und Tourismus Baden-Württemberg im Rahmen des Forums Gesundheitsstandort BW geförderten SolidCAR-T-Projekt modular skalierbare Produktionseinheiten, quasi „Minifabriken“, entwickelt werden, die CAR-T-Zellen in einem standardisierten und automatisierten Prozess mit hoher Qualität vor Ort herstellen können. Die Produktion des Therapeutikums wird damit technologiebasierter, breiter verfügbar und kann an den lokalen Bedarf angepasst werden.
Die zentrale Komponente der „Minifabriken“ sind normierte Kassetten, in die die T-Lymphozyten direkt von der Leukapherese gelangen. In ihnen durchlaufen die Zellen die unterschiedlichen Stationen des Produktionsprozesses. Jede Kassette enthält Biokammern, in denen abhängig vom Produktionsschritt andere Bedingungen herrschen. Denn: „Für die Transduktion mit Lentiviren bestehen andere Anforderungen an die Zellumgebung als während der Expansionsphase, in der die Zellen sich vermehren“, führt Sarah Kleine-Wechelmann aus, die zusammen mit Traube das Projekt am Fraunhofer IPA koordiniert. Durch normierte, sterile Anschlüsse wird höchste hygienische Sicherheit gewährleistet. „Da die einzelnen Systeme geschlossen sind, werden wir geringere Anforderungen an den Standort haben und deshalb in einer niedrigeren Reinraumklasse produzieren können, was Aufwand und Kosten enorm reduziert.“ Des Weiteren ermöglicht der modulare Aufbau die Skalierbarkeit und Anpassbarkeit und ebnet damit den Weg für die parallele Verarbeitung verschiedener Produktklassen in einer Infrastruktur.
CAR-T-Zellen gegen solide Gallengangtumore
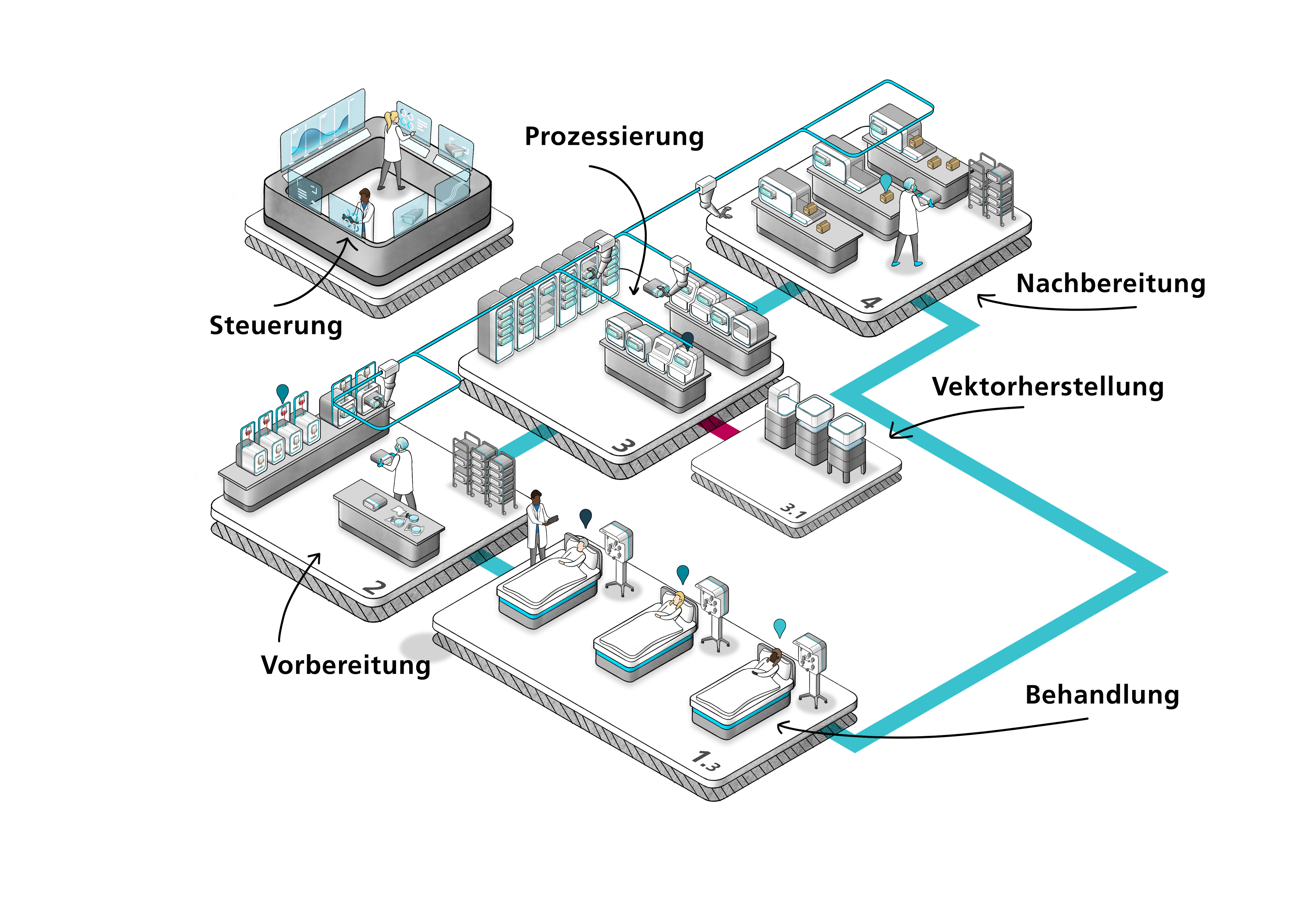 Visionsdarstellung des modularen Produktionskonzeptes, der „Minifabrik“, die dezentral in Kliniken eine kostengünstigere Produktion von CAR-T-Zellen ermöglichen soll. © Fraunhofer IPA
Visionsdarstellung des modularen Produktionskonzeptes, der „Minifabrik“, die dezentral in Kliniken eine kostengünstigere Produktion von CAR-T-Zellen ermöglichen soll. © Fraunhofer IPADas UKT besitzt eine hohe Expertise im Bereich der Herstellung und Nutzung zellulärer Therapien. Im Rahmen des Projekts SolidCAR-T arbeitet die Arbeitsgruppe von Dr. Christian Seitz, Klinik für Kinder- und Jugendmedizin, zusammen mit der Inneren Medizin I unter der Leitung von Prof. Dr. Nisar Malek an der Etablierung und Optimierung der Herstellungsprozesse von CAR-T-Zellen zur Behandlung des Gallengangkarzinoms. Im Gegensatz zu B-Zell-Tumoren handelt es sich hierbei um solide Gewebetumoren, die meist relativ spät im fortgeschrittenen Stadium diagnostiziert werden und dann nur noch schwer behandelbar sind.
Die Kernaufgabe des NMI unter Leitung von Prof. Dr. Katja Schenke-Layland besteht in der Qualitätssicherung der Zellprodukte. Darüber hinaus wird mithilfe von patientenabgeleiteten Tumormodellen in Kombination mit Organ-on-a-Chip-Systemen im Labormodell nachgebildet, was in Patientinnen und Patienten passiert. Das unterstützt einerseits die Qualitätssicherung und kann zudem Voraussagen über die Wirksamkeit der Zellprodukte treffen, noch bevor die Erkrankten das Präparat bekommen. „Das SolidCAR-T-Projekt ist die Chance für eine Weiterentwicklung der Präzisionsmedizin“, betont die Wissenschaftlerin.
Die parallele Entwicklung von Herstellungsprozess und Produktionsmaschinerie innerhalb eines Produktionssystems bildet dabei den Kern des mit 4 Mio. Euro unterstützten SolidCAR-T-Projekts.
Prozessmonitoring verbessert Qualitätssicherung
Eine weitere Besonderheit im Vergleich zum derzeitigen Verfahren wird das kontinuierliche Monitoring der einzelnen Schritte sein, das eine Anpassung der Prozessparameter an die Bedürfnisse der Zellen ermöglicht und somit die Qualität verbessert. „Unser großes Ziel ist es, die Produktionseinheiten bei gleichbleibender Qualität problemlos an neue Standorte transferieren und auf andere Zellsysteme übertragen zu können“, beschreibt Traube das Zukunftsszenario. „Dafür ist das Parametermonitoring eine wichtige Voraussetzung.“ SolidCAR-T soll zudem den Grundstein für ein Landeszentrum zur Produktion individualisierter Zelltherapeutika legen, das langfristig den Technologietransfer zu Industriepartnern ermöglicht. Da nach derzeitiger Annahme etwa jeder zehnte Krebspatient für eine Personalisierte Arzneimitteltherapie infrage kommt, besteht großer Bedarf an Produktionskapazitäten, um bezahlbare Produkte herstellen zu können.