Computergestütztes Genome Mining
Naturstoffgenomik eröffnet neue Wege bei der Antibiotikasuche
Antibiotikaresistente Erreger gefährden zunehmend unsere Gesundheit. Da die meisten der derzeit verwendeten Medikamente auf Sekundärmetaboliten basieren, die von Bakterien oder Pilzen produziert werden, entwickelt die Arbeitsgruppe von Prof. Dr. Nadine Ziemert aus Tübingen bioinformatische Tools, um das Genom dieser Organismen gezielt auf bisher unbekannte antimikrobielle Wirkstoffe zu durchsuchen.
Viele Bakterien, Pilze und Pflanzen stellen nicht nur die für Wachstum, Entwicklung und Vermehrung erforderlichen Substanzen her, sondern produzieren im Rahmen des sogenannten Sekundärstoffwechsels noch weitere Verbindungen. Diese nicht lebensnotwendigen, niedermolekularen Sekundärmetaboliten haben verschiedenste Aufgaben. Einige dienen als Signal- bzw. Kommunikationsstoffe oder auch als Fraßschutz. Andere wiederum hemmen spezifisch die Vermehrung konkurrierender und pathogener Mikroorganismen in der Umgebung oder töten sie sogar ab.
Die meisten der heutzutage in der Medizin verwendeten Antibiotika, wie beispielsweise Penicilline, Streptomycin, Chloramphenicol und Tetrazykline, basieren auf solchen überwiegend von Bakterien und Pilzen produzierten Naturstoffen. Es handelt sich hierbei um hochkomplexe Verbindungen, die aus ungewöhnlichen Bausteinen bestehen und nur mit Hilfe spezialisierter Enzyme synthetisiert werden können. Die Moleküle blockieren grundlegende Prozesse des Zielorganismus und wirken häufig gegen mehrere Bakterienarten (Breitbandantibiotika). Da sie an Strukturen bzw. Mechanismen angreifen, die in menschlichen Zellen nicht vorkommen, sind sie in der Regel gut verträglich.
Neue Antibiotika werden dringend benötigt
 Prof. Dr. Nadine Ziemert von der Universität Tübingen sucht mit Hilfe der Naturstoffgenomik nach neuen Antibiotika. © Universität Tübingen
Prof. Dr. Nadine Ziemert von der Universität Tübingen sucht mit Hilfe der Naturstoffgenomik nach neuen Antibiotika. © Universität TübingenAufgrund des jahrzehntelangen und breiten Einsatzes vieler Antibiotika bilden die Erreger inzwischen allerdings zunehmend Resistenzen aus. Infektionen mit multiresistenten Keimen können zu schweren körperlichen Schäden führen und verursachen nach neuesten Schätzungen der Weltgesundheitsorganisation (WHO) weltweit jährlich den Tod von 1,3 Mio. Menschen.1)
„Es ist bereits fünf vor zwölf; wir benötigen dringend neue Antibiotika. Und da die traditionelle Vorgehensweise sehr langwierig ist, müssen wir andere Wege beschreiten“, beschreibt Prof. Dr. Nadine Ziemert von der Universität Tübingen die Situation. Sie forscht an der Schnittstelle zwischen mikrobieller Ökologie, Mikrobiologie und Bioinformatik und entwickelt in ihrer Arbeitsgruppe am Interfakultären Institut für Mikrobiologie und Infektionsmedizin computergestützte Methoden, die die Identifizierung neuer antimikrobieller Naturstoffe schneller und effektiver machen sollen. Denn „das Potenzial der bakteriellen Sekundärmetaboliten ist noch lange nicht ausgeschöpft. Wir sollten es nutzen, da die Natur die Wirkmechanismen im Laufe der Evolution optimal angepasst hat.“
Mittels Naturstoffgenomik relevante biosynthetische Gencluster identifizieren
Der Großteil der heutzutage eingesetzten Antibiotika entstammt den im Boden weit verbreiteten Actinobakterien, vor allem den Streptomyzeten. Bei der klassischen Suche nach neuen Substanzen werden deshalb immer noch hauptsächlich Organismen aus Bodenproben im Labor angezogen und die Wirkung der von ihnen produzierten Stoffe auf bekannte Krankheitserreger getestet. Im Laufe der Untersuchungen stellt sich dann leider häufig heraus, dass die Verbindungen bereits bekannt sind. Da das Prozedere zudem sehr aufwendig und der finanzielle Ertrag eher gering ist, hat sich die Pharmaindustrie schon vor Jahren aus der Antibiotikaforschung zurückgezogen.
Ziemert und ihr Team hingegen wählten den neuartigen Ansatz des Genome Mining (Naturstoffgenomik) und analysieren die im bakteriellen Erbgut vorhandenen Informationen. Seit der Entschlüsselung des Genoms von Haemophilus influenzae als erstem Mikroorganismus im Jahr 1995 nehmen diese Datenmengen rasant zu. Die Biologin und Bioinformatikern führt aus: „Wenn ich weiß, wie ich die DNA lesen muss, dann kann ich auch Substanzen identifizieren, die nur unter speziellen Bedingungen hergestellt werden. Am Rechner habe ich so die Möglichkeit, Organismen zu untersuchen, die noch nie im Labor kultiviert wurden. Die große Herausforderung ist es, Algorithmen und Datenbanken zu entwickeln, die die relevanten Informationen aus den riesigen Datenmengen herausfiltern können.“
Dabei machen es sich die Forschenden zunutze, dass für die Synthese eines Sekundärmetaboliten fast immer sogenannte biosynthetische Gencluster (BGCs) verantwortlich sind. Dies sind Ansammlungen von teilweise mehr als 75 Genen, die alle eng benachbart im Genom vorliegen. Antimikrobiell wirkende Naturstoffe gehören oft zur Klasse der nichtribosomalen Peptide (Aminosäureketten, die nicht wie üblich am Ribosom in der Zelle entstehen) oder zu den Polyketiden (gebildet aus Acetat-Einheiten). Synthetisiert werden sie von großen, modular aufgebauten Multienzymkomplexen, den nichtribosomalen Peptid-Synthetasen bzw. den Polyketid-Synthasen. Da die zugrundeliegenden Gene sehr spezifische Sequenzen enthalten, lassen sich die relevanten BGCs mit bioinformatischen Methoden inzwischen schnell identifizieren. „Schwierig ist es dann allerdings zu unterscheiden, ob Bakterien mit ähnlichen Genclustern den gleichen Naturstoff herstellen oder Verbindungen aus unterschiedlichen Klassen“, erläutert die Professorin für Translationale Naturstoffgenomik.
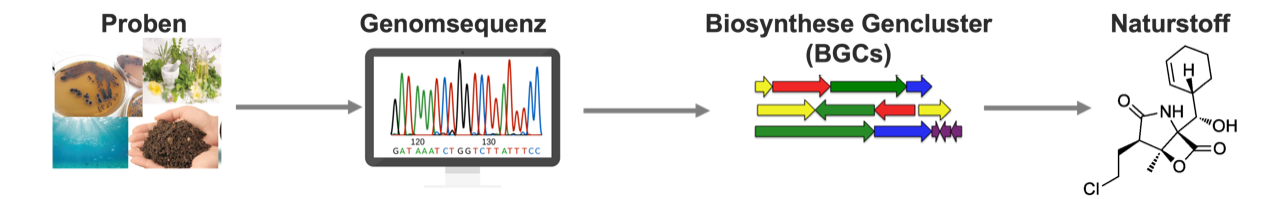 Anhand der Genomsequenz von Bakterien und Pilzen aus verschiedensten Proben werden biosynthetische Gencluster identifiziert, die für die Produktion eines Naturstoffes verantwortlich sind. © Universität Tübingen
Anhand der Genomsequenz von Bakterien und Pilzen aus verschiedensten Proben werden biosynthetische Gencluster identifiziert, die für die Produktion eines Naturstoffes verantwortlich sind. © Universität Tübingen
Viele unerforschte Sekundärmetaboliten in Bakterien vorhanden
Um herauszufinden, wie groß die chemische Vielfalt der von Bakterien produzierten Naturstoffe ist, und in welchen Organismen die Suche nach neuen Antibiotika den größten Erfolg verspricht, analysierte die Doktorandin Athina Gavriilidou fast 170.000 Genome von kultivierten und bereits sequenzierten Bakterien. In diesen identifizierte sie mehr als 50.000 verschiedene Naturstoffklassen, von denen bisher aber nur etwa 2.500 bekannt sind. Die im letzten Jahr im renommierten Fachmagazin Nature Microbiology publizierten Daten2) verdeutlichen den Umfang des versteckten Potenzials und definieren zudem unbekannte „Hotspots“ unter den Bakteriengattungen, die genetisch sehr vielfältig und dementsprechend vielversprechend für die Suche nach neuen Wirkstoffen sind.
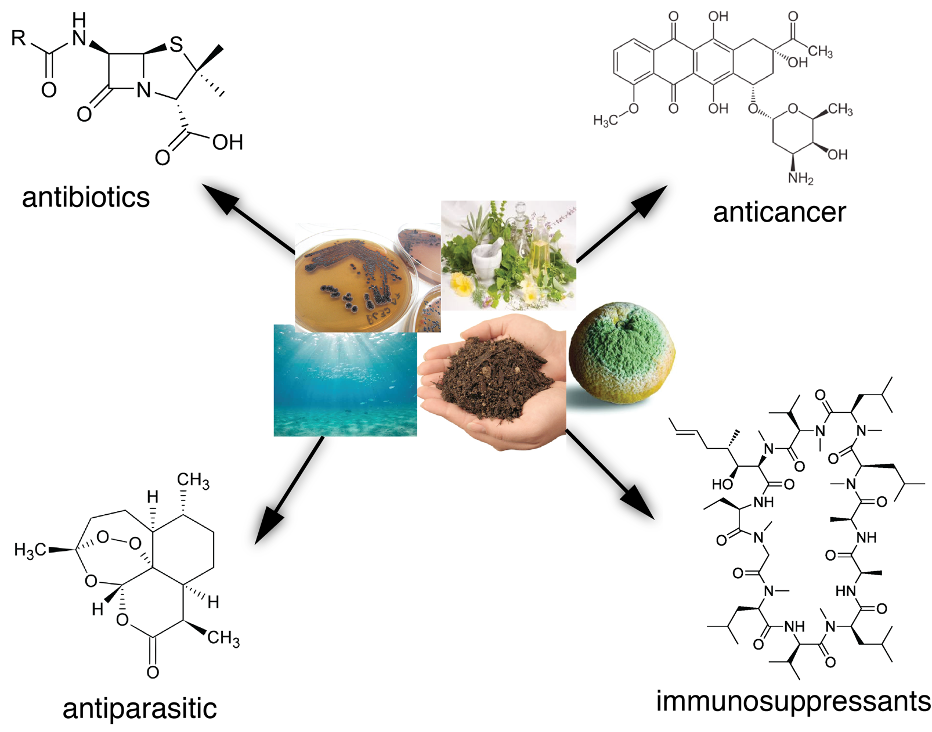 Einige der in Bakterien und Pilzen unterschiedlichster Herkunft produzierten Sekundärmetaboliten können als Antibiotikum, Antikrebsmittel, Immunsuppressivum oder gegen Parasiten wirken. © Universität Tübingen
Einige der in Bakterien und Pilzen unterschiedlichster Herkunft produzierten Sekundärmetaboliten können als Antibiotikum, Antikrebsmittel, Immunsuppressivum oder gegen Parasiten wirken. © Universität TübingenDes Weiteren betrachteten die Forschenden das genetische Material aus verschiedenen Umweltproben, das sogenannte Metagenom. Dieses wird ohne Kultivierungsschritt im Labor direkt aus den Proben gewonnen und beinhaltet die Genome aller vorhandenen Bakterien. Es zeigte sich, dass die Hälfte der hier vorkommenden Naturstoffklassen bisher völlig unbekannt war und es sich deshalb lohnen kann, direkt in der Umgebung zu suchen.
Die interdisziplinäre Arbeitsgruppe, die dem Deutschen Zentrum für Infektionsforschung (DZIF) angehört und auch an das Interfakultäre Institut für Biomedizinische Informatik angegliedert ist, konnte bereits einige interessante BGCs identifizieren. Die Kultivierung der entsprechenden Bakterien sowie die Isolierung und Charakterisierung der wirksamen Substanzen ist jetzt die nächste Herausforderung. Hierbei kooperieren die Forschenden eng mit ihren Kolleginnen und Kollegen vom Tübinger Exzellenzcluster CMFI (Controlling Microbes to Fight Infections). „Auch unsere Methode braucht ihre Zeit, aber die Voraussetzungen sind besser als wenn wir zufällig suchen“, schildert Ziemert.
Breiter Einsatz der Naturstoffgenomik
Grundsätzlich ist sie an allen Sekundärmetaboliten interessiert und möchte verstehen, welche Substanzen in bestimmten Lebensgemeinschaften unter welchen Bedingungen produziert werden, und wie diese zusammenwirken. Denn die Naturstoffe erweisen sich immer mehr als wichtige Komponenten komplexer ökologischer Systeme. „Mit diesem Wissen könnten wir zukünftig den Begriff Antibiotikum erweitern und eventuell mit Hilfe von Sekundärmetaboliten das lokale Mikrobiom vorab so stärken, dass pathogene Organismen schlechtere Chancen haben. Sei es, um Pflanzen resistent gegen Keime zu machen, oder um die immunmodulatorischen Effekte unseres Darmmikrobioms zu unterstützen“, beschreibt die Pionierin der Naturstoffgenomik ihre Vision.
Da viele Sekundärmetabolite auch für ihre Produzenten schädlich sind, enthalten die BGCs häufig Gene, deren Proteinprodukte einen Schutz vermitteln. Dies können recht unspezifische Transporter sein, die den Wirkstoff aus der Zelle befördern, oder Enzyme, die ihn zerstören. Teilweise handelt es sich aber auch um eine veränderte Version des Zielproteins, an die die Substanzen nicht binden können. In solchen Fällen enthalten die Gencluster also zusätzlich wichtige Informationen über den Wirkmechanismus. Beim Target-directed Genome Mining nutzt man dies aus und sucht anhand der Sequenz eines vorher definierten Targets (Zielproteins) konkret nach BGCs, die für die Herstellung einer relevanten Substanz verantwortlich sind. Diese Methode lässt sich auf alle Naturstoffe anwenden und kann ebenso bei der Suche nach neuen Anti-Krebsmitteln, Analgetika oder Immunsuppressiva eingesetzt werden.