Personalisierte Medizin
Pharmakogenomik ermöglicht individuelle Arzneimittel-Verschreibung
Jeder Mensch ist einzigartig, und genauso individuell kann seine Reaktion auf Medikamente sein. Aus diesem Grund kommt es immer wieder zu unerwarteten Nebenwirkungen bei gängigen Arzneimitteln, zum Teil mit lebensbedrohlichen Folgen. Am Dr. Margarete Fischer-Bosch-Institut für Klinische Pharmakologie (IKP) in Stuttgart wird der Einfluss von Erbfaktoren auf diese schädlichen Reaktionen untersucht, um so eine individuelle Therapie zu ermöglichen.
Unerwünschte Arzneimittel-Wirkungen können trotz korrekter Dosierung und Indikation auftreten; sie sind bei fast sieben Prozent der Patientinnen und Patienten der Grund für die Vorstellung in der Notaufnahme. Dass für einige dieser Nebenwirkungen genetische Faktoren verantwortlich sind, wurde bereits während des 2. Weltkrieges erkannt. So traten beispielsweise bei afroamerikanischen Soldaten nach Gabe von Anti-Malariamitteln vermehrt hämolytische Anämien (Blutarmut) auf, die mit einem Mangel am Enzym Glucose-6-Phosphat-Dehydrogenase (G6PD) in Zusammenhang standen. Dieser genetisch bedingte Defekt ist unter Menschen aus Afrika, dem Nahen Osten und Südasien weit verbreitet und führt zu einer erhöhten Empfindlichkeit der roten Blutkörperchen gegenüber dem Medikament.
Verstoffwechselung über Cytochrom P450-System
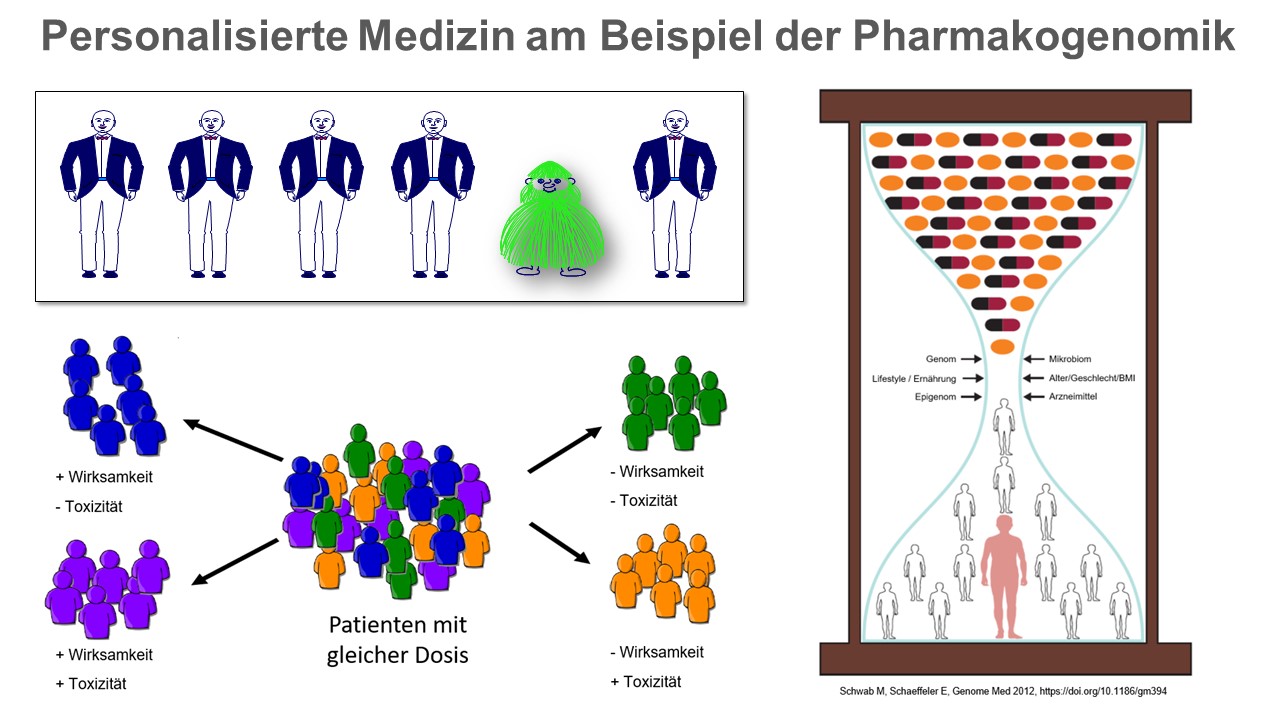 Genetische Faktoren können die Wirksamkeit bzw. die Toxizität von Arzneistoffen beeinflussen. Des Weiteren sind nicht genetische Faktoren wie z.B. Alter, Geschlecht, Lebensumstände bzw. Komedikation zu berücksichtigen. Vor kurzem wurde das Epigenom (Gesamtheit der vererbbaren chemischen Veränderungen an DNA und assoziierten Proteinen) bzw. das Mikrobiom (Gesamtheit der Mikroorganismen eines Individuums) als zusätzlicher Einflussfaktor für die Variabilität der Arzneimittelwirkung identifiziert. © IKP Stuttgart
Genetische Faktoren können die Wirksamkeit bzw. die Toxizität von Arzneistoffen beeinflussen. Des Weiteren sind nicht genetische Faktoren wie z.B. Alter, Geschlecht, Lebensumstände bzw. Komedikation zu berücksichtigen. Vor kurzem wurde das Epigenom (Gesamtheit der vererbbaren chemischen Veränderungen an DNA und assoziierten Proteinen) bzw. das Mikrobiom (Gesamtheit der Mikroorganismen eines Individuums) als zusätzlicher Einflussfaktor für die Variabilität der Arzneimittelwirkung identifiziert. © IKP StuttgartBasierend auf diesen Erkenntnissen prägte der deutsche Humangenetiker Friedrich Vogel bereits Ende der 1950er-Jahre den Begriff der Pharmakogenetik, der den Einfluss individueller Genvarianten auf die Wirkung von Arzneimitteln beschreibt. Vor allem Gene, deren Proteinprodukte an der Aufnahme, Verteilung, Umwandlung und Ausscheidung der Arzneistoffe beteiligt sind, sogenannte ADME-Gene (Absorption, Distribution, Metabolism and Excretion), spielen hier eine Rolle. Zu ihnen zählt auch das Cytochrom P450-System, dessen Enzyme für die Umwandlung von bis zu 80 Prozent der Medikamente verantwortlich sind. Einige dieser Cytochrome P450 besitzen eine hohe genetische Variabilität, das heißt in der Bevölkerung existieren unterschiedliche Genvarianten, die eine erhöhte oder verringerte Aktivität nach sich ziehen. Für die betroffenen Personen bedeutet dies, dass sie manche Medikamente schneller, langsamer oder eventuell gar nicht umsetzen können.
Einige Arzneimittel, beispielsweise viele Schmerzmittel wie Codein, werden in der Leber von einer inaktiven Vorläuferform (Prodrug) zur aktiven Wirkform umgesetzt. Im Fall eines genetisch bedingten Proteinmangels bzw. einer Fehlfunktion des Cytochrom P450 2D6-Enzyms, wovon zehn Prozent der deutschen Bevölkerung betroffen sind, ist hier eine signifikant geringere schmerzstillende Wirkung von Codein zu erwarten, da dieses nicht zu seinem wirksamen Metaboliten umgewandelt werden kann. Hier steht also nicht die Nebenwirkung des Medikaments im Vordergrund, sondern eine fehlende Wirksamkeit, womit sich die Pharmakogenetik ebenfalls beschäftigt.
Genvarianten können beträchtlichen Schaden anrichten
 Prof. Matthias Schwab untersucht den Einfluss genetischer Faktoren auf die Wirksamkeit von Arzneimitteln. © IKP Stuttgart
Prof. Matthias Schwab untersucht den Einfluss genetischer Faktoren auf die Wirksamkeit von Arzneimitteln. © IKP StuttgartProf. Dr. Matthias Schwab vom Dr. Margarete Fischer-Bosch-Institut für Klinische Pharmakologie (IKP) in Stuttgart, der auch Lehrstuhlinhaber der Universität Tübingen für das Fach Klinische Pharmakologie ist, beschäftigt sich seit vielen Jahren mit dem Einfluss genetischer Faktoren auf die Wirkung von Arzneimitteln. „Zum Nutzen für die Patienten richten wir unsere wissenschaftlichen Untersuchungen so aus, dass die Arzneimitteltherapie sicherer wird und für den einzelnen Patienten optimal angepasst ist“, beschreibt er seine Forschungstätigkeit. Vor allem bei Präparaten mit einem engen therapeutischen Wirkspektrum können Genvarianten gravierende Schäden verursachen. Für seine umfassenden Arbeiten zu den Auswirkungen eines veränderten TPMT-Gens (Thiopurin-S-Methyltransferase) wurde ihm 2016 einer der bedeutendsten Medizinpreise in Deutschland, der Robert-Pfleger-Forschungspreis, verliehen.
Das TPMT-Gen kodiert für ein Enzym, das an der Verstoffwechselung von Thiopurinen beteiligt ist, die z. B. standardmäßig zur Behandlung der akuten kindlichen Leukämie, aber auch zur Behandlung von chronisch entzündlichen Darmerkrankungen, eingesetzt werden. Aufgrund einer genetisch bedingten verringerten Enzymaktivität kommt es unter der Standardmedikation bei ca. zehn Prozent der Erkrankten zu einer gravierenden „Überdosierung“ und infolgedessen zu einer Knochenmarksschädigung, die im schlimmsten Fall tödlich verlaufen kann. Aus diesem Grund wird bei jedem Kind mit einer Leukämieerkrankung in Deutschland vor Beginn einer Thiopurintherapie die TPMT-Aktivität untersucht. Zudem konnten Schwab und sein Team zeigen, dass Genvarianten in einem weiteren an der Verstoffwechselung von Thiopurinen beteiligten Enzym NUDT15 (Nudix Hydrolase 15) bei Europäern unter Thiopurintherapie ebenfalls zu Knochenmarksschäden führen können.
Ein anderer Schwerpunkt der Arbeitsgruppe liegt in der Entwicklung neuer Therapiekonzepte für die Behandlung von hormonabhängigem Brustkrebs mit dem Medikament Tamoxifen, dessen Wirksamkeit von der vorliegenden Cytochrom P450 2D6-Genvariante abhängt.
EU-weite pharmakogenomische Studie
Inzwischen sind Hunderte Veränderungen in verschiedenen ADME-Genen bekannt, die Einfluss auf die Wirksamkeit und/oder Sicherheit eines Arzneimittels haben. Im Gegensatz zur Pharmakogenetik ist der Ansatz der Pharmakogenomik breiter gefasst und bezieht das gesamte Genom und das Zusammenspiel verschiedener Gene ein.
Das 2017 im Rahmen des EU-Programms für Forschung und Innovation Horizont 2020 gegründete Ubiquitous Pharmacogenomics (U-PGx)-Konsortium, das Schwab als Vice-Chair leitet, führte die EU-weite Studie PREPARE (PREemptive Pharmacogenomic Testing for Prevention of Adverse Rrug REactions ) durch, die die klinische Relevanz einer vorbeugenden pharmakogenomischen Diagnostik zur Vermeidung unerwünschter Arzneimittel-Wirkungen überprüfte. Die Ergebnisse der Studie werden Ende 2021 erwartet. Vor Therapiebeginn wurden mehr als 40 klinisch relevante genetische Marker untersucht, die die Wirksamkeit bzw. das Auftreten von unerwünschten Nebenwirkungen bei häufig verschriebenen Medikamenten beeinflussen. Bei der Hälfte der Patientinnen und Patienten wurde, abhängig vom pharmakogenomischen Ergebnis, gegebenenfalls die Medikamentengabe angepasst, während in der Kontrollgruppe die Standardtherapie durchgeführt wurde. Diese multizentrische Studie soll die Relevanz der pharmakogenomischen Diagnostik im klinischen Alltag mit dem Ziel überprüfen, nicht nur die Therapie zu verbessern, sondern auch zu belegen, dass die Kosten für die Untersuchung einen routinemäßigen Einsatz rechtfertigen.
Zielgerichtete Arzneistoffentwicklung
In einigen Fällen, wie zum Beispiel bei der Mukoviszidose, kann mit Hilfe der Pharmakogenomik bereits gezielt therapiert werden. Mukoviszidose, auch Cystische Fibrose (CF) genannt, ist eine der häufigsten vererbten Erkrankungen. Aufgrund einer Mutation im CFTR-Gen (Cystic Fibrosis Transmembrane Conductance Regulator) werden in der Zellmembran nicht oder nur eingeschränkt funktionsfähige Chlorid-Kanäle gebildet. Dies führt zur Ansammlung von zähflüssigem Schleim in der Lunge, aber auch zu Veränderungen in anderen Organen. Für ausgewählte Varianten des CFTR-Gens wurden zielgerichtete Arzneistoffe entwickelt, die bereits zugelassen sind und eine personalisierte Therapie der Mukoviszidose ermöglichen.
Bisher spielt die pharmakogenomische Diagnose in der alltäglichen Praxis allerdings noch eine untergeordnete Rolle. Die oben genannte Studie PREPARE soll weitere Evidenz für den klinischen Alltag bringen, um flächendeckend eine entsprechende Diagnostik umsetzen zu können.
Die rasante Entwicklung in der Hochdurchsatz-Sequenzierung (Next Generation Sequencing) ermöglicht es, innerhalb kürzester Zeit umfassend, sensitiv und spezifisch Auskunft über Veränderungen des individuellen Genoms zu geben. Im Gegensatz zu üblichen Laborkontrollen bzw. genetischen Analysen im Rahmen der Tumordiagnostik verändern sich genetische Varianten der Keimbahn im Laufe des Lebens nicht, sodass eine einmalige präemptive Diagnostik ausreichend ist. Unter der Voraussetzung, dass für das entsprechende Medikament wissenschaftlich und klinisch belegt ist, dass Veränderungen in Arzneimittelgenen die Therapie beeinflussen, eröffnet die Pharmakogenomik die Möglichkeit, für Patientinnen und Patienten eine optimale Arzneimitteldosierung bereitzustellen.