Lab-on-a-chip
Mikrofluidische Plattform für die bestmögliche Krebstherapie
Jeder Tumor und jeder Patient ist anders, zudem gibt es individuelle Reaktionen auf Medikamente und Resistenzen. Patientenspezifische Krebsbehandlungen erfordern innovative und kostengünstige Ansätze. Das TheraMe!-Konsortium hat ein neuartiges Instrument entwickelt: eine Kombination aus mikrofluidischen Experimenten und mathematischer Modellierung, die im Rahmen der Krebs-Präzisionsmedizin eingesetzt werden und Fehltherapien vermeiden soll.
Aufgrund der steigenden Zahl von Krebserkrankungen wird intensiv nach Möglichkeiten geforscht, um die Tumorentstehung und -ausbreitung besser verstehen und dagegen vorgehen zu können. Der Knackpunkt: Es gibt keine standardisierten Krebserkrankungen, wodurch die effektive Behandlung erschwert ist. Jeder Patient und somit auch jeder Tumor ist anders, und die Reaktion auf Medikamente fällt daher individuell und verschieden aus. Deshalb rücken innovative Verfahren in den Fokus, welche es erlauben, spezifisch für jeden Patienten die bestmögliche Therapie zu ermitteln.
Im Laufe der Jahre wurden viele Ansätze zur Personalisierten Medizin entwickelt, doch nur sehr wenige haben es in die klinische Routine geschafft. Gründe sind die hohen Anforderungen: Personalisierte Ansätze sollen innerhalb nur weniger Stunden bis Tage umsetzbar sein, um die Therapie zeitnah anzupassen. Gleichzeitig sind erschwingliche Kosten gefordert, verglichen mit konventionellen Behandlungen mit unwesentlichen Zusatzkosten. Außerdem sollen für diagnostische Tests nur kleine Probenmengen von Patientenmaterial erforderlich sein. In all diesen Punkten bietet TheraMe! eine Lösung: Mithilfe von mikrofluidischer Technologie können die Probenvolumina auf einen Mikroliter, also einen Millionstel Liter, reduziert werden. Somit bieten die limitierten Patientenbiopsien ausreichend Material für umfangreiche Testreihen. Das in Heidelberg gegründete internationale Konsortium mit Beteiligung des Europäischen Laboratoriums für Molekularbiologie (EMBL) Heidelberg kann ein umfassendes Patentportfolio vorweisen und plant die Gründung eines Biotech-Start-ups, das diagnostische Verfahren und Instrumente zur Personalisierten Krebstherapie kommerziell anbieten wird. Dieses Vorhaben wird durch das Förderprogramm des Bundesministeriums für Wirtschaft und Energie EXIST Grant mit rund 820.000 Euro gefördert. Bei der Expertise dahinter verwundert das nicht: Das Konsortium kann auf ein interdisziplinäres Fachwissen aus Mikrofluidik (Arbeitsgruppe Merten), Bioinformatik (Arbeitsgruppe Saez-Rodriguez), klinischer Onkologie (Arbeitsgruppe Cramer) sowie auf Experten der Bereiche Physik, Biomedizin und Wirtschaft zurückgreifen.
 Die Arbeitsgruppen von Prof. Dr. Christoph Merten (links), Prof. Dr. Julio Saez-Rodriguez (Mitte) und Prof. Dr. Thorsten Cramer (rechts) haben sich zum TheraMe! Konsortium zusammengeschlossen, um neuartige Wege in der personalisierten Krebstherapie zu gehen.
© TheraMe!
Die Arbeitsgruppen von Prof. Dr. Christoph Merten (links), Prof. Dr. Julio Saez-Rodriguez (Mitte) und Prof. Dr. Thorsten Cramer (rechts) haben sich zum TheraMe! Konsortium zusammengeschlossen, um neuartige Wege in der personalisierten Krebstherapie zu gehen.
© TheraMe!
Arzneimittelscreening miniaturisiert
In bisherigen Analysen ist die Zellzahl, die aus soliden Tumoren gewonnen werden kann, zu gering, um umfangreiche Tests direkt am Tumor durchzuführen. Hier bietet die Mikrofluidik enormes Potenzial: Aufgrund des miniaturisierten Designs können tausende Untersuchungen pro Biopsie durchgeführt werden. Dabei werden die Tumorzellen des Patienten einer Kombination von Medikamenten ausgesetzt. Nach 24 Stunden wird ermittelt, welche der Kombinationen die Tumorzellen am effizientesten abtötet. „Wir wollten eine Plattform schaffen, welche es erlaubt, schnell und günstig die beste Tumortherapie für jeden einzelnen Patienten zu jedem beliebigen Zeitpunkt, zum Beispiel auch nach dem Auftreten von Resistenzen, zu ermitteln“, erklärt Prof. Dr. Christoph Merten, Leiter der Forschungsgruppe Biomedizinische Mikrofluidik an der Eidgenössischen Technischen Hochschule Lausanne (EPFL ) und außerordentlicher Wissenschaftler am Ludwig Institut für Krebsforschung (LICR) in Lausanne. Schon seit über 15 Jahren befasst er sich mit mehr als 30 Wissenschaftlern im Rahmen seiner Forschungsarbeiten in England (MRC-LMB Cambridge), Frankreich (ISIS Strasbourg), Deutschland (EMBL Heidelberg) und der Schweiz (EPFL Lausanne) mit mikrofluidischen Ansätzen. „Zusammen mit unseren Partnern Prof. Dr. Saez-Rodriguez, Prof. Dr. Cramer und Prof. Dr. Eduati wollen wir die Personalisierte Präzisionsmedizin für die Krebstherapie weiter voranbringen und durch ein Start-up kommerziell anbieten.“
Geno- und phänotypische Analysen statt „One size fits all“
Der hohe Automatisierungsgrad erlaubt komplexe Modellstudien. „Es geht bei der Krankheitsmodellierung darum, sowohl phänotypische als auch genotypische Eigenschaften zu berücksichtigen“, so Merten. „One size fits all“, wie man es zum Beispiel bei einer bevölkerungsweiten Grippeimpfung kennt, bietet hier keine Lösung. „Mikrofluidisch gesteuerte Personalisierte Therapieansätze hingegen integrieren Daten aus einem breiten Testspektrum und der Patientengeschichte, um die optimale Behandlung für jeden Patienten zu definieren.“
TheraMe! gewinnt Krebszellen in einer ausreichenden Zellzahl sowohl direkt aus Tumorbiopsien als auch aus resezierten Tumoren, also vom Ort des Primärtumors. So werden verzerrende Kultivierungsschritte umgangen. „Durch Nutzung direkter Patientenproben lässt sich die Tumorheterogenität besser abdecken“, erklärt Merten. „Mit unseren Assays können wir die Wirksamkeit von Medikamenten beurteilen, noch bevor diese den Patienten appliziert werden.“ Solche phänotypischen Eigenschaften sind bedeutsam, denn jeder Patient reagiert anders auf Medikamente. In Zukunft werden auch Tests auf genetischer Ebene durchgeführt. So können neue Biomarker entdeckt werden, welche helfen, die Wirksamkeit verschiedener Medikamente für jeden Patienten vorauszusagen. Zudem werden mithilfe dieser Tests bis zu tausendfach mehr Datenpunkte pro Patient und getestetem Medikament gewonnen, wodurch die Vorhersagen bezüglich der bestmöglichen Therapie präziser werden.
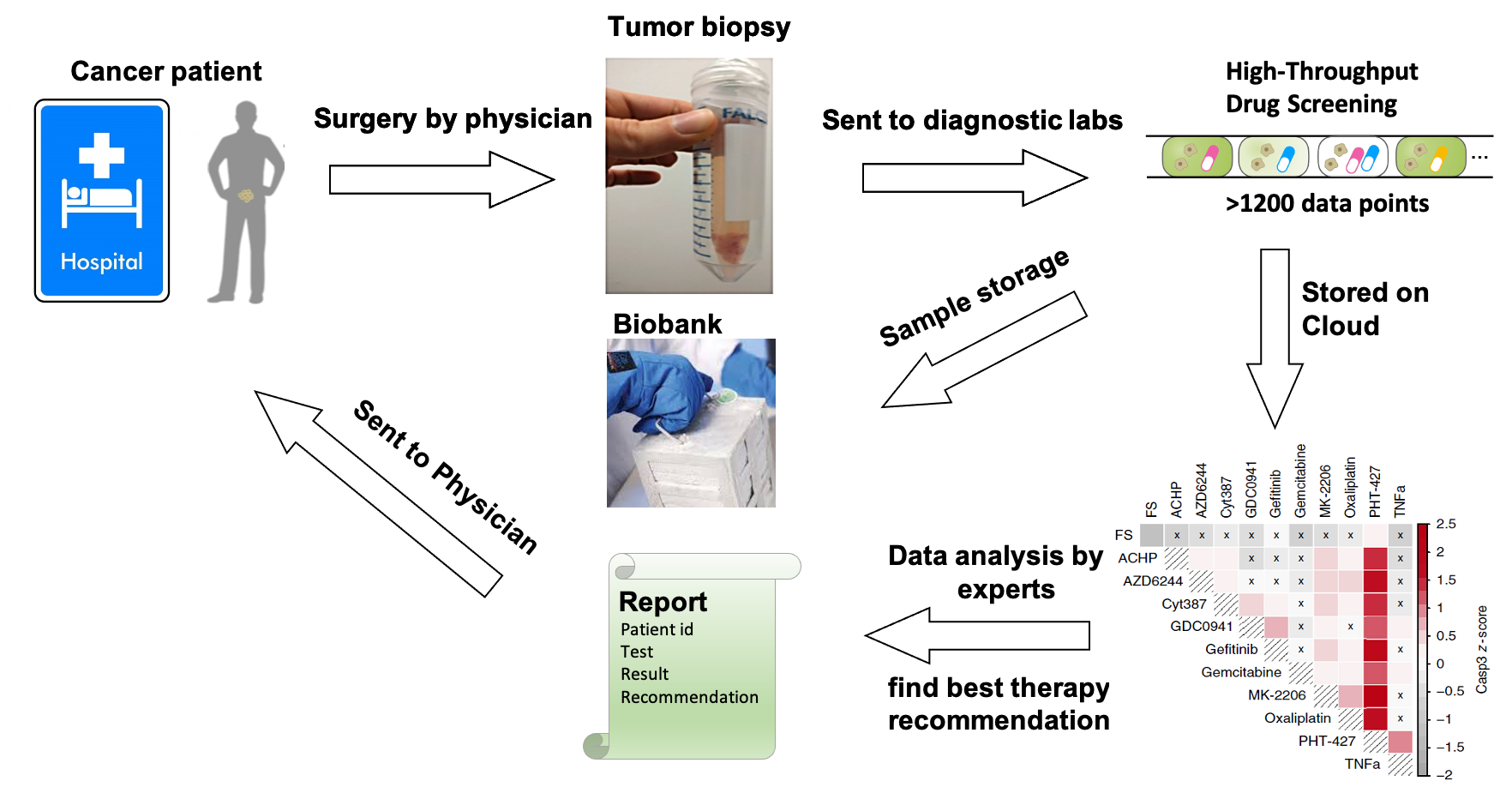 TheraMe!-Workflow zur Ermittlung der bestmöglichen Therapieoption für jeden Patienten © TheraMe!
TheraMe!-Workflow zur Ermittlung der bestmöglichen Therapieoption für jeden Patienten © TheraMe!Damit übertrifft der TheraMe!-Ansatz die derzeit gängigen Verfahren bei weitem, wie Merten erklärt: „Die Mehrzahl der heutigen Verfahren nutzt Sequenzierungen, um bekannte Biomarker zu detektieren und daraus Wahrscheinlichkeiten für einen Therapieerfolg einiger weniger Optionen abzuleiten. Diese Verfahren testen aber nicht, wie sehr sich das gesamte Transkriptom und damit auch die krebsrelevanten Signalwege für bis zu hunderte von Therapieoptionen verändern. Außerdem erlaubt unsere Analyse der Signalwege, auch unabhängig von den derzeit eher wenigen bekannten Biomarkern, die bestmögliche Therapieoption für jeden Patienten individuell zu ermitteln.
Kleine Tröpfchen mit großem Output – Mikrofluidik als zukünftiges Routinewerkzeug
Anstatt herkömmliche Reagenzgläser oder Mikrotiterplatten zu verwenden, die mehr Zellen benötigen als von einem Patienten entnommen werden können, führt TheraMe! Arzneimitteltests in mikroskopisch kleinen Tröpfchen durch.
 Mikrofluidischer Chip, der mit neuster 3D-Druckmethode hochpräzise hergestellt wird. In Kanälen mit einem Durchmesser von unter einem Zehntelmillimeter werden Krebszellen, Medikamente, Reagenzien und Öl eingespritzt, um mikroskopisch kleine Messgefäße in Form von wässrigen Tropfen in einer Öl-Phase herzustellen. Durch diese Art der Miniaturisierung können deutlich mehr Tests mit Patientenzellen durchgeführt werden als zuvor. © TheraMe!
Mikrofluidischer Chip, der mit neuster 3D-Druckmethode hochpräzise hergestellt wird. In Kanälen mit einem Durchmesser von unter einem Zehntelmillimeter werden Krebszellen, Medikamente, Reagenzien und Öl eingespritzt, um mikroskopisch kleine Messgefäße in Form von wässrigen Tropfen in einer Öl-Phase herzustellen. Durch diese Art der Miniaturisierung können deutlich mehr Tests mit Patientenzellen durchgeführt werden als zuvor. © TheraMe!Der Ansatz bietet viele Vorteile gegenüber bestehenden Technologien. So wird nicht nur das Ansprechen auf einzelne Medikamente, sondern auf hunderte von Behandlungsoptionen getestet und auf einem einzigen Bildschirm dargestellt – als „nackter Output“ - nicht als Wahrscheinlichkeiten. Dabei werden Daten zu den vielfältigen Medikamententest bereits vor Therapiebeginn zur Verfügung gestellt. Auf diese Weise müssen sich Patienten nicht nebenwirkungsreichen Therapien unterziehen, die sich später als ineffizient erweisen. Das Team um Merten kann beachtliche Entwicklungen vorweisen: „Die Ergebnisse liegen innerhalb von 24 Stunden nach Gewinnung einer sehr kleinen Biopsieprobe vor, und zwar zu Kosten, die erheblich niedriger sind als bei Standarddiagnoseverfahren wie MRT-Scans. Unser System ermöglicht es, die besten Therapieoptionen direkt an lebenden Tumorproben von Patienten zu bestimmen. Wir konnten unseren Ansatz an Mäusen validieren und das Verfahren auch an Biopsien von Tumorpatienten erfolgreich demonstrieren.“
Die Kerntechnologie von TheraMe! ist durch ein erteiltes US-Patent bereits geschützt, zwei weitere Patente für zusätzliche Technologien sind angemeldet. Merten ist seit 2017 auch wissenschaftlicher Gründer eines weiteren Start-ups, das mikrofluidische Technologie erfolgreich für die Antikörperentwicklung einsetzt – Perspektiven erstrecken sich bis in die Immunonkologie. Durch die Umstellung der Ansätze von herkömmlichen Reagenzgläsern auf mikroskopisch kleine Tropfen ergeben sich vielfältige Möglichkeiten für neuartige Therapien und Medikamente.
Das könnte Sie auch interessieren ...