Behandlungserfolg bei Krebs vorhersagen
Darmmikrobiom im Fokus bei CAR-T-Zelltherapie
Krebsimmuntherapien nutzen die körpereigenen Abwehrkräfte, um Tumorzellen zu bekämpfen. Ein internationales Konsortium um Forschende aus Deutschland und den USA unter Leitung des DKFZ Heidelberg konnte nun nachweisen, dass die Wirksamkeit der CAR-T-Zelltherapien maßgeblich von der Zusammensetzung des Darmmikrobioms abhängt. Auf dieser Basis gelang es außerdem, ein Vorhersagemodell für das langfristige Ansprechen auf die Behandlung zu entwickeln.
Seit einigen Jahren kommen bei der Behandlung von Krebserkrankungen vermehrt Immuntherapien zum Einsatz. Diese Verfahren schalten die Tarnmechanismen der Tumore aus, sodass das körpereigene Immunsystem die Krebszellen erkennen und vernichten kann.
Alle kernhaltigen Körperzellen tragen auf ihrer Oberfläche Moleküle des HLA- (Humanes Leukozyten Antigen-) Systems, die Peptide aus dem Zellinneren präsentieren. Da jeder Mensch ein individuelles Set an HLA-Molekülen besitzt, ist es dem Immunsystem möglich, zwischen körpereigenen und fremden Zellen zu unterscheiden. Werden aufgrund einer Infektion neue Proteine innerhalb der Zelle hergestellt oder verändern sich körpereigene Proteine, wie es häufig in Krebszellen der Fall ist, so ändern sich auch die präsentierten Peptide. Normalerweise entdecken zytotoxische T-Lymphozyten dies mit speziellen Erkennungsmolekülen (Rezeptoren) und vernichten die entsprechende Zelle. Gelegentlich gelingt es allerdings einzelnen Krebsvorläufern, dem Überwachungssystem zu entgehen und sich unbemerkt zu vermehren. Oft geschieht dies, weil die Tumorzellen beispielsweise keine Peptide mehr präsentieren oder gezielt die T-Lymphozyten hemmen.
Vorhersageparameter für aufwändige CAR-T-Zelltherapie notwendig
 Unter Leitung von Prof. Dr. Christoph Stein-Thöringer bestimmten Forschende aus Deutschland und den USA den Einfluss des Darmmikrobioms auf den Behandlungserfolg von CAR-T-Zelltherapien. © Universitätsklinikum Tübingen
Unter Leitung von Prof. Dr. Christoph Stein-Thöringer bestimmten Forschende aus Deutschland und den USA den Einfluss des Darmmikrobioms auf den Behandlungserfolg von CAR-T-Zelltherapien. © Universitätsklinikum TübingenAn beiden Punkten setzen die neuartigen Immuntherapien an. Durch sogenannte Checkpoint-Inhibitoren lassen sich hemmende Signale von Tumorzellen abschirmen, sodass die T-Lymphozyten wieder aktiviert werden. Die CAR-T-Zelltherapie hingegen umgeht die HLA-abhängige Erkennung der Tumorzelle, indem T-Lymphozyten der Erkrankten gentechnisch so verändert werden, dass sie tumorspezifische Moleküle (Antigene) auf der Krebszelle direkt erkennen können. Zu diesem Zweck erhalten die T-Zellen im Labor die genetische Information für einen synthetischen, sogenannten chimären Antigen Rezeptor (CAR). Dieser besteht aus einer antikörperähnlichen Erkennungsdomäne, dem membrangebundenen Teil des T-Zell-Rezeptors und einer signalauslösenden Domäne im Zytoplasma der Zelle. Die Bindung der CARs an das Zielmolekül auf der Tumorzelle führt zur Aktivierung der T-Lymphozyten und nachfolgend zur Zerstörung der Tumorzelle. Aktuell kommen CAR-T-Zelltherapien bei Leukämien und Lymphomen zum Einsatz, die durch entartete B-Zellen verursacht wurden, und sind gegen den Oberflächenmarker CD19 gerichtet.
„Die CAR-T-Zelltherapie ist eine personalisierte Tumortherapie, die sowohl technisch als auch personell sehr aufwendig und demensprechend teuer ist [mehrere 100.000 Euro, Anm. d. Red.]“, erläutert Prof. Dr. Christoph Stein-Thöringer, seit Juli 2022 Professor für Translationale Mikrobiomforschung am Universitätsklinikum Tübingen. „Die entnommenen T-Zellen werden in einem Speziallabor zumeist in den USA modifiziert, und die Betroffenen erhalten sie erst nach einer vorangegangenen Chemotherapie zurück. Trotz hoher initialer Ansprechraten profitieren langfristig leider nur etwa 40 Prozent der Patienten von dem Verfahren. Wir brauchen deshalb dringend Methoden, um herauszufinden, für wen die Therapie geeignet ist. Bislang gibt es keinerlei Messparameter, die dies anzeigen können, sondern nur klinische Zusammenhänge wie Alter, Tumorgröße oder physische Konstitution.“
Darmmikrobiom beeinflusst Immuntherapien
Da sich die CAR-T-Zellen im Körper zunächst vermehren und reifen müssen, hängt ihre endgültige Aktivität stark vom Allgemeinzustand des Immunsystems ab. Neuere Erkenntnisse zeigen, dass eine effektive Immunabwehr auf einem intakten intestinalen Mikrobiom beruht, also der Gesamtheit der Mikroorganismen wie Bakterien, Viren und Pilzen im Darm. Jeder Mensch besitzt dabei eine individuelle Kombination der bis zu 1.000 verschiedenen Mikroorganismen, die sowohl genetisch bedingt als auch abhängig von den Ernährungsgewohnheiten und den Umgebungskontakten ist. Vor allem von Bakterien produzierte Stoffwechselprodukte wie kurzkettige Fettsäuren oder Metabolite der Aminosäure Tryptophan unterstützen dabei nicht nur die Ausbildung der Darmbarriere, sondern haben beispielsweise auch direkten Einfluss auf die Aktivität von T-Zellen. Der Mediziner führt aus: „Aus Klinischen Studien wissen wir bereits, dass für ein gutes Therapieansprechen bei Checkpoint-Inhibitoren oder auch Stammzelltransplantationen ein gesundes Darmmikrobiom erforderlich ist. Erzeugt man durch Antibiotikagabe ein Ungleichgewicht, eine sogenannte Dysbiose, dann wirken Checkpoint-Inhibitoren, die ja auf funktionierenden T-Zellen beruhen, nicht so gut. Wir haben jetzt den Einfluss des Mikrobioms auf CAR-T-Zelltherapien näher untersucht.“
Unter Leitung von Stein-Thöringer, der damals als Wissenschaftler am Deutschen Krebsforschungszentrum (DKFZ) in Heidelberg in der Abteilung für Mikrobiom und Krebs von Prof. Dr. Eran Elinav tätig war, beteiligte sich ein internationales Konsortium aus den Universitätskliniken Heidelberg, München und Regensburg sowie dem MD Anderson Cancer Center in Texas und dem Moffitt Cancer Center in Florida an der Studie. Die im März 2023 im renommierten Wissenschaftsjournal Nature Medicine publizierten Daten1) zeigen deutlich, dass Patientinnen und Patienten, die in den drei Wochen vor Therapiebeginn ein Breitspektrum-Antibiotikum erhielten, eine signifikant reduzierte Überlebensrate hatten. Dies ist einerseits darin begründet, dass die Betroffenen eine erhöhte Tumorlast und mehr Infekte hatten. „Aber wir konnten auch nachweisen, dass die durch die Antibiotika induzierte Dysbiose ebenfalls dazu beiträgt“, erläutert der Internist.
Um den Effekt des Darmmikrobioms auf den Therapieerfolg besser verstehen zu können, konzentrierten sich die Forschenden in weiteren Analysen auf Personen, die keine Antibiotika erhalten hatten. So konnten sie verschiedene Spezies identifizieren, die entweder mit einem positiven Verlauf und längeren Überlebenszeiten oder aber mit einem schlechten Ausgang assoziiert waren. Mithilfe von Machine Learning-Technologien entwickelten sie dann auf Basis des Darmmikrobioms ein Vorhersagemodell für das langfristige Ansprechen auf eine CAR-T-Zelltherapie. Der Studienleiter schildert: „Der Prozess war jedoch kompliziert und erste Modelle auf Basis aller Studienteilnehmer versagten, da das Darmmikrobiom von antibiotikabehandelten Patienten zu dysbiotisch ist. Der Ansatz, diese auszuschließen, war neu und entscheidend. Er ermöglichte es uns, eine verlässliche Mikrobiomsignatur zu identifizieren, sodass das Vorhersagemodell dann sowohl in der deutschen als auch in der amerikanischen Patientenkohorte funktionierte.“
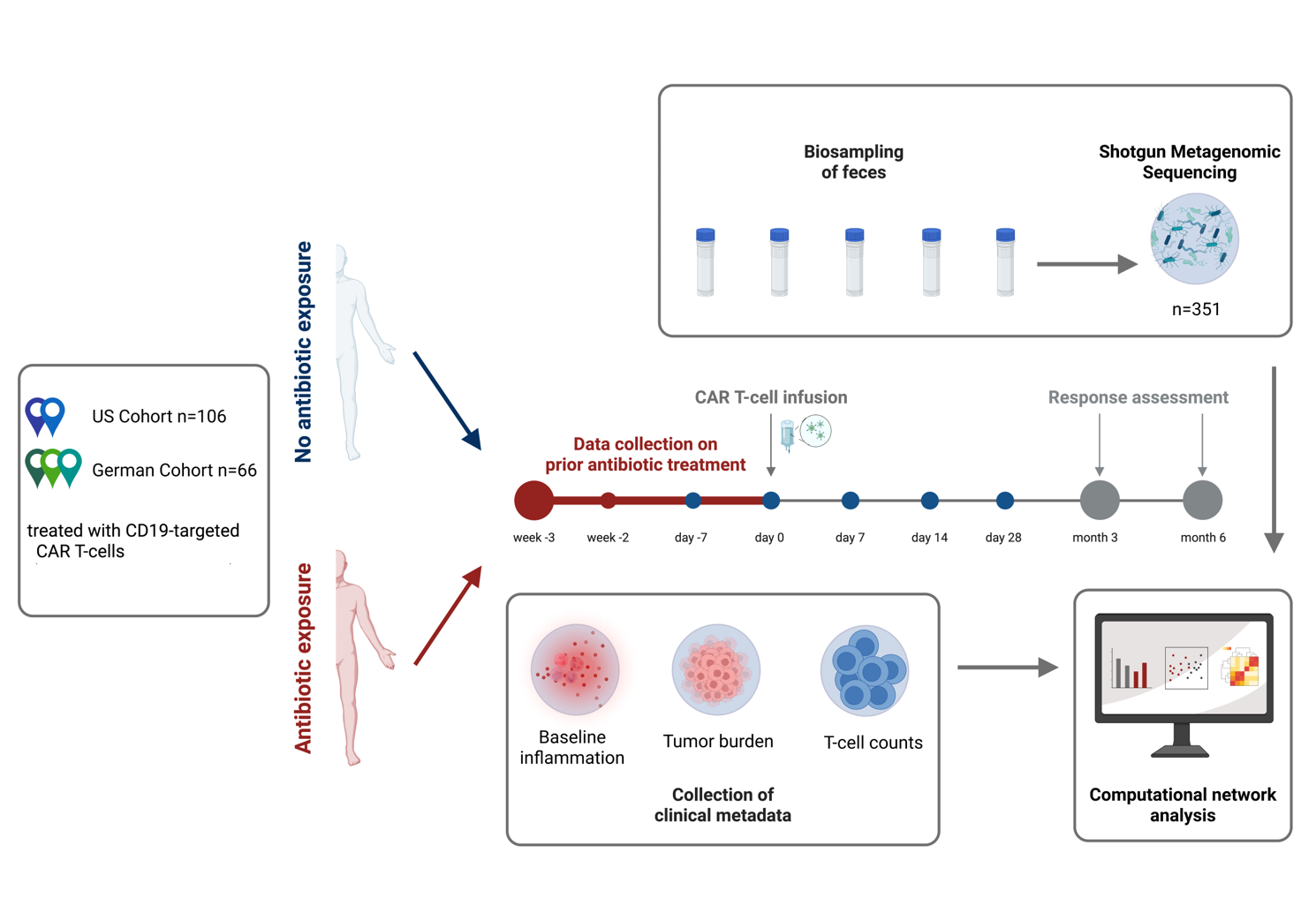 In drei deutschen und zwei amerikanischen Zentren erhielten 66 bzw. 106 Probandinnen und Probanden die gegen CD19 gerichtete CAR-T-Zellen. Für die Auswertung wurden einerseits die klinischen Daten der Betroffenen erfasst als auch in regelmäßigen Abständen vor, während und nach der CAR-T-Zell-Infusion Stuhlproben entnommen und das Darmmikrobiom mithilfe der Shotgun Metagenomic Sequencing Methode analysiert. Auf Basis der nicht mit Antibiotika behandelten Personen aus Deutschland wurde ein Vorhersagemodell erstellt und in der US-Kohorte validiert. © C. Stein-Thöringer, UKT und V. Blumenberg, LMU München
In drei deutschen und zwei amerikanischen Zentren erhielten 66 bzw. 106 Probandinnen und Probanden die gegen CD19 gerichtete CAR-T-Zellen. Für die Auswertung wurden einerseits die klinischen Daten der Betroffenen erfasst als auch in regelmäßigen Abständen vor, während und nach der CAR-T-Zell-Infusion Stuhlproben entnommen und das Darmmikrobiom mithilfe der Shotgun Metagenomic Sequencing Methode analysiert. Auf Basis der nicht mit Antibiotika behandelten Personen aus Deutschland wurde ein Vorhersagemodell erstellt und in der US-Kohorte validiert. © C. Stein-Thöringer, UKT und V. Blumenberg, LMU München
Neue Behandlungskonzepte denkbar
Die von der Mark Foundation for Cancer Research und der BW Stiftung geförderten Untersuchungen zeigen weiterhin, dass bestimmte Darmbakterien schon vor Therapiebeginn mit einer höheren Anzahl an T-Lymphozyten im Blut korrelieren. In diesen Fällen können mehr Zellen für die Therapie entnommen werden, und das CAR-T-Zellprodukt ist voraussichtlich auch besser ist als bei Personen, die unter einer Dysbiose leiden. „Unsere Daten belegen den Einfluss des Darmmikrobioms auf die zytotoxische Immunabwehr eindeutig“, so Stein-Thöringer. „Deshalb arbeiten wir bereits intensiv daran, die funktionellen Interaktionen zwischen einzelnen Spezies und den CAR-T-Zellen zu identifizieren. Vielleicht ist es dann zukünftig möglich, vor Therapiebeginn mithilfe immunmodulatorischer Metabolite oder spezieller Probiotika möglichst günstige Voraussetzungen zu schaffen. Grundsätzlich sollten Antibiotika sparsam und gezielt verwendet werden. In der Tumormedizin kommt man allerdings oft nicht um ihren Einsatz herum, da die Patienten häufig unter Infektionen leiden. Ein weiterer Themenschwerpunkt meiner Arbeitsgruppe ist es deshalb, Mittel und Wege zu finden, die schädlichen Effekte der Antibiotika auf das Mikrobiom abzufedern.“
Bestätigen sich die von Stein-Thöringer und seinen Kolleginnen und Kollegen gefundenen Zusammenhänge in weiteren Studien, dann stünden in Zukunft erstmals konkrete Messparameter zur Verfügung, um die Wirksamkeit der aufwendigen CAR-T-Zelltherapie für einzelne Patientinnen und Patienten vorherzusagen. Zudem ließen sich durch Maßnahmen, die bestimmte Mikroorganismen im Darm fördern, die Erfolgschancen der Behandlung deutlich erhöhen.