Organ-on-Chip zur Analyse von Arzneimittelwirkungen
Neue 3D-Zellplattform erlaubt kontinuierliches Stoffwechselmonitoring
In Organ-on-Chip-Systemen werden menschliche Zellen in organähnlichen Ministrukturen gezüchtet und untersucht. Durch die Integration von Mikrosensoren schufen Forschende des IMTEK Freiburg zusammen mit der Klinik der RWTH Aachen eine neuartige Variante, die die Messung der Stoffwechselaktivität direkt vor Ort und in Echtzeit erlaubt. Dies ermöglicht die schnelle und detaillierte Analyse von Arzneimittelwirkungen außerhalb eines Organismus.
In vitro-Zellkultursysteme sind unerlässlich für die Erforschung biologischer Vorgänge, aber auch, um Wirkung und Verträglichkeit von Medikamenten zu testen. Zellen, die sich im Organismus nicht innerhalb eines Verbandes befinden, wie beispielsweise Blut- und Immunzellen, werden dabei in Nährlösung schwimmend als sogenannte Suspensionskultur angezogen. Die meisten Zelltypen wachsen allerdings adhärent, das heißt, sie vermehren sich nur, wenn sie an einer Oberfläche anhaften. In konventionellen zweidimensionalen (2D) Systemen werden diese Zellen in Nährmedium auf einer Glas- oder Plastikunterlage kultiviert und bilden eine einzellige Schicht, eine Monolage. Dies spiegelt die Situation in einem Organ aber nur ungenügend wider, denn dort wachsen Zellen in dreidimensionalen Verbänden und interagieren in allen Richtungen miteinander. Aus diesem Grund sind die mithilfe einer 2D-Kultur gewonnenen Erkenntnisse nur eingeschränkt auf einen lebenden Organismus übertragbar.
In den letzten Jahren wird deshalb verstärkt an der Etablierung von dreidimensionalen Modellsystemen gearbeitet, in denen die Zellen in Form von organähnlichen Ministrukturen wachsen, sogenannten Organoiden. Da hierbei die Ausbildung von organtypischen Eigenschaften gefördert wird, liefern 3D-Kulturen klinisch relevantere Ergebnisse. Seit einiger Zeit ist es zudem möglich, die Miniorgane auf speziellen Plattformen zu züchten, die mithilfe von kleinen Kammern und Kanälen die Mikroumgebung eines Gewebes imitieren können. In diesen Organ-on-Chip-Systemen lässt sich die Versorgung mit Nährstoffen und Arzneimitteln präzise steuern und der Einfluss auf das Wachstum der Zellen gut beobachten. Die Messung von Stoffwechselparametern erfolgt allerdings bisher überwiegend durch Fluoreszenzfärbung und die Entnahme von Nährmedium oder Zellmaterial.
Integrierte Mikrosensoren erlauben Echtzeitmessung
 Dr. Andreas Weltin und Johannes Dornhof vom IMTEK aus Freiburg entwickelten ein neuartigen Organ-on-Chip-System, mit dem die Stoffwechselaktivität der Zellen direkt vor Ort und in Echtzeit gemessen werden kann. © Andreas Weltin und Johannes Dornhof
Dr. Andreas Weltin und Johannes Dornhof vom IMTEK aus Freiburg entwickelten ein neuartigen Organ-on-Chip-System, mit dem die Stoffwechselaktivität der Zellen direkt vor Ort und in Echtzeit gemessen werden kann. © Andreas Weltin und Johannes DornhofForschenden des Instituts für Mikrosystemtechnik (IMTEK) an der Universität Freiburg ist es jetzt in einem von der Baden-Württemberg Stiftung geförderten Projekt gelungen, ein neuartiges Organ-on-Chip-Modell zu entwickeln, das es erlaubt, die Stoffwechselaktivität der Zellen lokal und in Echtzeit zu verfolgen. Die Besonderheit des Systems liegt in der Integration verschiedener Mikrosensoren, über die ein kontinuierliches Monitoring im Sekundentakt möglich ist. „Die Bestimmung von Sauerstoff beispielsweise muss direkt vor Ort erfolgen, ein vorausgehendes Abpumpen des Nährmediums würde die Daten verfälschen“, erläutert Dr. Andreas Weltin, Gruppenleiter an der Professur für Sensoren. Da der Verbrauch des im Medium vorhandenen Sauerstoffs unmittelbar mit der aeroben Zellatmung korreliert, also der Energiegewinnung durch den Abbau von Glucose zu Kohlenstoffdioxid und Wasser, dient er als Maß für die Vitalität der Zellen. „Möglich ist die Messung nur, da wir im Unterschied zu vielen anderen Organ-on-Chip-Plattformen gasdichte Materialien verwenden“, ergänzt Doktorand Johannes Dornhof, Erstautor der kürzlich veröffentlichten Arbeiten.1) Der Boden des 10 x 16 mm großen Chips besteht beispielsweise aus Glas, die Wände der Kanäle und Zellkammern sind aus einem epoxid-basierten Photopolymer und die Abdeckung aus Plexiglas gefertigt.
Dieses gasdichte System ist vor allem für die Kultivierung und Untersuchung von Tumorzellen essenziell. Aufgrund ihres schnellen Wachstums besitzen viele solide Tumore sauerstoffarme (hypoxische) Bereiche, die die Metastasierung fördern und das Ansprechen auf Therapien verringern. Aussagekräftige Modelle müssen diese Bedingungen deshalb nachbilden. „Wir können den Sauerstoffgehalt zwischen luftähnlichen und stark hypoxischen Verhältnissen variieren“, hebt Weltin hervor. In enger Zusammenarbeit mit Dr. Jochen Maurer, dem wissenschaftlichen Leiter der Molekularen Gynäkologie an der Klinik für Gynäkologie und Geburtsmedizin des Universitätsklinikums RWTH Aachen, übertrugen die Mikrosystemtechniker die von dem Biologen etablierte Kultivierung von Brustkrebsstammzellen auf den Chip. Die Zellen werden dabei in einem Gel in die Wachstumskammern eingebracht und über die an den Seiten entlanglaufenden Mikrokanäle mit Nährstoffen versorgt. Dank Mikrofluidik kann die Bewegung der geringen Flüssigkeitsmengen in den Kanälen aktiv gesteuert werden, wohingegen der Stofftransport innerhalb der Zellkammern per Diffusion stattfindet.
Live-Analyse des Energiestoffwechsels
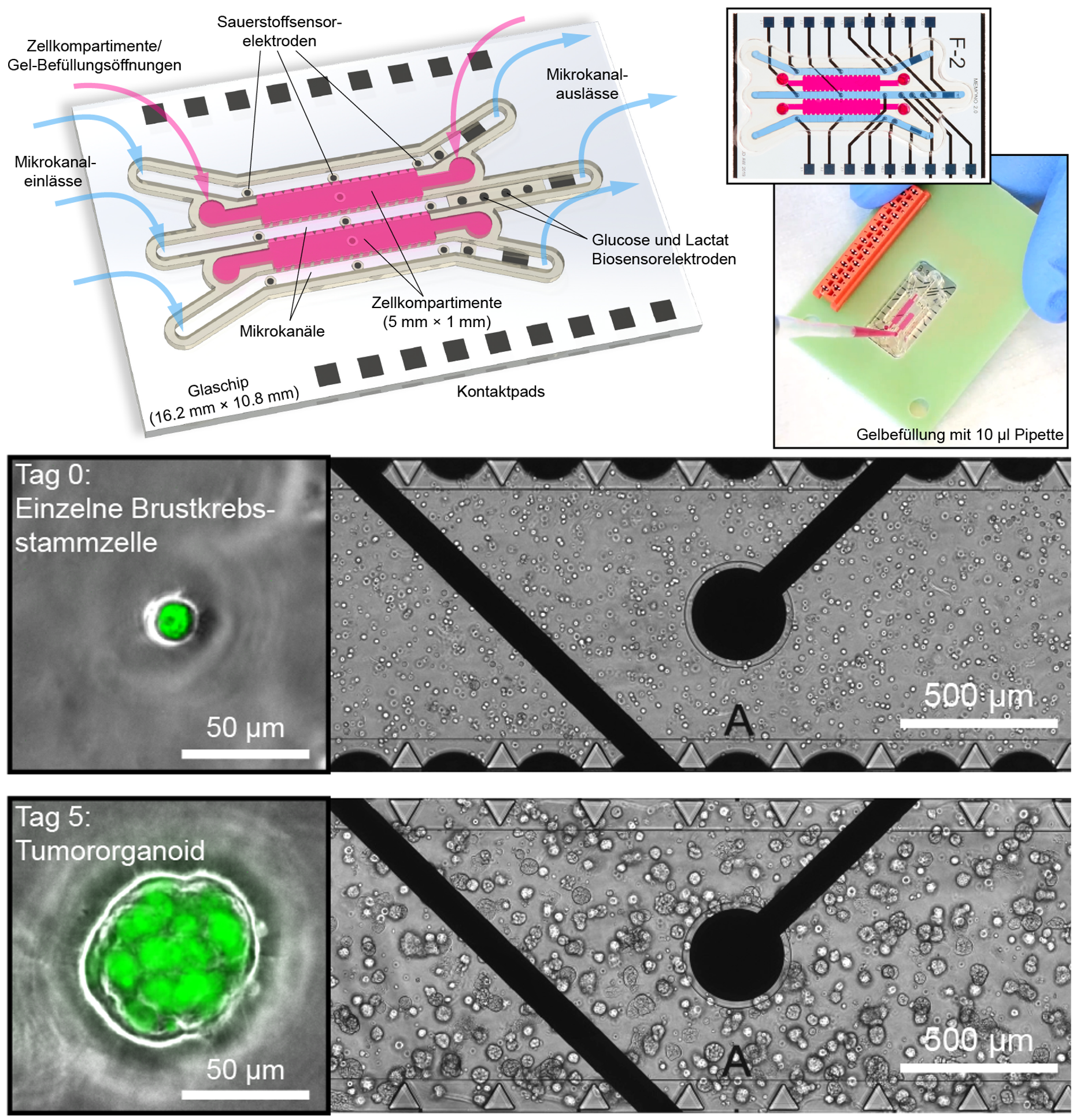 In Organ-on-Chip-Systemen werden Stammzellen in dreidimensionalen, organähnlichen Verbänden vermehrt und untersucht. Die innovative Variante aus Freiburg enthält neben Zellwachstumskammern (pink) und Mikrokanälen zusätzlich noch mehrere unterschiedliche Mikrosensoren (schwarze Kreise), über die ein kontinuierliches Monitoring möglich ist. Unten: Aus einzelnen Brustkrebsstammzellen (grün) entwickeln sich innerhalb von 5 Tagen kleine Tumororganoide. © Andreas Weltin und Johannes Dornhof
In Organ-on-Chip-Systemen werden Stammzellen in dreidimensionalen, organähnlichen Verbänden vermehrt und untersucht. Die innovative Variante aus Freiburg enthält neben Zellwachstumskammern (pink) und Mikrokanälen zusätzlich noch mehrere unterschiedliche Mikrosensoren (schwarze Kreise), über die ein kontinuierliches Monitoring möglich ist. Unten: Aus einzelnen Brustkrebsstammzellen (grün) entwickeln sich innerhalb von 5 Tagen kleine Tumororganoide. © Andreas Weltin und Johannes DornhofMithilfe der Sauerstoffsensoren untersuchten die Forschenden im Stop/Flow-Verfahren beispielhaft die Wirkung des Krebstherapeutikums Doxorubicin. Nach Versorgung mit frischer Nährlösung (Flow-Phase) nimmt der enthaltene Sauerstoff in der Stopp-Phase ab, da er von den lebenden Zellen veratmet wird. Die Zugabe des Medikaments tötet die Zellen, was durch eine reduzierte Sauerstoffabnahme erkennbar ist. Weltin berichtet begeistert: „Über die Sensorsignale merken wir sofort, dass die Zellen nicht mehr atmen, obwohl sie noch gesund erscheinen. Das ist ein großer Vorteil gegenüber herkömmlichen Methoden, bei denen das Ergebnis teilweise erst nach Tagen sichtbar ist.“ Sein Team konnte zudem klar zeigen, dass die in 2D-Kulturen ermittelte wirksame Konzentration für Doxorubicin nicht effektiv in organähnlichen Zellverbänden ist, sondern hier die zehnfache Menge eingesetzt werden muss.
Das Organ-on-Chip-System enthält zusätzlich noch Sensoren für Glucose und das bei Sauerstoffmangel gebildete Lactat (Milchsäure). Über diese Grundgrößen kann der Energiemetabolismus der Zelle verfolgt werden, sodass sich auch die Kulturbedingungen optimal einstellen lassen. Die Messung weiterer Parameter ist ebenfalls problemlos möglich. "Die Sensorprinzipien sind überall dieselben. In einer kleinen elektrochemischen Zelle wird die Stoffkonzentration über eine Mikroelektrode gemessen", erläutert Weltin. "Die Basis besteht jeweils aus einer Platinelektrode, die durch Modifikationen und entsprechenden Messprotokollen selektiv in einen spezifischen Sensor umgewandelt wird."
Vielfältige Einsatzgebiete
Ein wichtiger Vorteil der Echtzeitbestimmung ist die Erfassung von temporären Veränderungen. Dornhof erklärt: „Wir können den Zellstoffwechsel live verfolgen und entdecken so auch Effekte, die nach einiger Zeit wieder verschwinden. Solche Informationen gehen bei Endpunktanalysen verloren.“ Aus diesem Grund eignet sich das neuartige System vor allem für detaillierte Untersuchungen zu Arzneimittelwirkungen und könnte in Zukunft Tierversuche ergänzen oder in einigen Bereichen sogar ersetzen.
Langfristig ist außerdem eine Anwendung auf dem Gebiet der Personalisierten Therapien geplant. Werden die Minitumore aus patienteneigenen Stammzellen gezüchtet, könnte vor der Behandlung die Wirkung der Medikamente untersucht und das am besten geeignete Arzneimittel identifiziert werden. Um dies zu realisieren, ist weiterhin ein hohes Maß an interdisziplinärer Zusammenarbeit zwischen Mikrosystemtechnikern, Medizinern und Zellbiologen erforderlich.