Die Transkription umschreiben, um zu heilen
Therapieren mit den Umlauten des genetischen Alphabets
tRNAs sind nicht nur Bausteine der Proteinfabrik, sondern sie spielen als molekulare Schalter auch eine aktive Rolle bei der Genregulation – und damit auch in Krankheitsprozessen wie Krebs. Das Heidelberger Start-up Umlaut.bio arbeitet derzeit an völlig neuartigen Medikamenten, die gezielt an tRNAs angreifen, um Erkrankungen direkt an der molekularen Ursache behandeln zu können.
Sehr lange Zeit galt der genetische Code in Form der vier Basen Adenin (A), Cytosin (C), Guanin (G) und Thymin (T) als Bauplan des Lebens und alleinige Information für funktionierende Zellen. Seit der Entwicklung immer leistungsfähigerer und detaillierterer Methoden zur Untersuchung von Nukleinsäuren, weiß man: so einfach wie ursprünglich einmal gedacht funktioniert die Umsetzung der Gene nicht.
 Dr. Bastian Linder ist CSO des Start-ups Umlaut.bio und langjähriger Experte für RNA-Forschung. © Umlaut.bio
Dr. Bastian Linder ist CSO des Start-ups Umlaut.bio und langjähriger Experte für RNA-Forschung. © Umlaut.bioDenn die DNA-Sequenz bildet zwar die Grundlage, zelluläre Entwicklungsprozesse werden aber auch maßgeblich durch eine zweite Regulationsebene – das Epigenom - gesteuert, etwa über Modifikationen wie Methylierungen. Aber damit noch nicht genug: Vor gut zehn Jahren entdeckte man auch noch eine dritte Regulationsebene, das Epitranskriptom. Hier wird die Genaktivität über chemische Modifikationen der Ribonukleinsäuren beeinflusst, ähnlich wie Umlaute in einem Text, die ihn zwar nicht grundsätzlich verändern, ihm jedoch eine zusätzliche Ebene an Klang und Feinabstimmung verleihen.
Die am häufigsten vorkommende chemische RNA-Modifikation ist m6A (N6-Methyladenosin). Lange vermutete man, dass sie die Stabilität und Verfügbarkeit der so veränderten mRNA reguliert – mehr und Gesichertes war jedoch nicht bekannt. Um dies herauszufinden, erstellte Dr. Bastian Linder als Post-Doc im New Yorker Labor von Samie Jaffrey und später am European Molecular Biology Laboratory (EMBL) in Heidelberg eine ganze Karte mit hunderten der so modifizierten mRNA-Nukleotide: „Aber auch nachdem wir die Nukleotide kartiert hatten, blieb ihre Funktion weiterhin unsicher, obwohl wir gedacht hatten, dass sich diese dann praktisch wie von selbst erschließen würde“, sagt er.
messenger RNA (mRNA) vs. transfer RNA (tRNA)
In der Zelle werden verschiedene Ribonukleinsäuren für verschiedene Aufgaben eingesetzt, unter anderem:
mRNA, die genetische Information wie ein Bote von der DNA zu den Ribosomen trägt und eine identische Abschrift der Erbinformation ist, die für die Herstellung eines Proteins benötigt wird.
tRNA, die die passenden Proteinbausteine – die Aminosäuren – zu den Ribosomen transportiert, über ihr Anticodon aus drei Basen das dazu komplementäre Codon auf der mRNA erkennt, sodass die Bausteine in der korrekten, in der Erbinformation festgelegten Reihenfolge zum Protein verknüpft werden.
Bislang unentdeckte Ebene der Genregulation
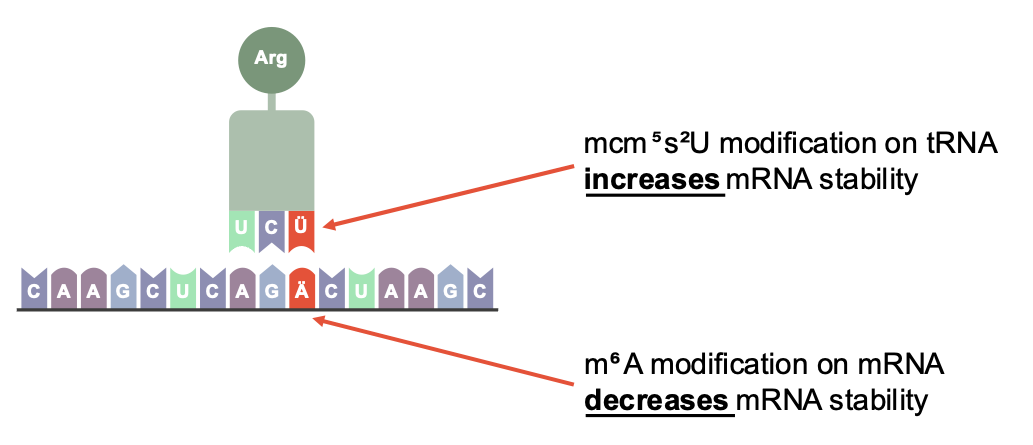 Schematische Darstellung der posttranskriptionellen Genregulation: Sowohl die Modifikation von mRNA als auch von tRNA kann darüber entscheiden, wie stabil Transkripte in der Zelle sind. © Umlaut.bio
Schematische Darstellung der posttranskriptionellen Genregulation: Sowohl die Modifikation von mRNA als auch von tRNA kann darüber entscheiden, wie stabil Transkripte in der Zelle sind. © Umlaut.bioBis vor Kurzem, denn nun konnte Linder gemeinsam mit einem internationalen Forschungsteam nachweisen, was bislang nur vermutet wurde. Nämlich, dass m6A, sobald in die Codierungssequenz einer mRNA eingebaut, zu einem beschleunigten mRNA-Abbau führt. Der Grund dafür: die so modifizierten Codons werden an den Ribosomen langsamer verarbeitet, die Translation kommt ins Stocken, und es entstehen Ribosomenkollisionen, was offenbar das Signal für den mRNA-Abbau ist. Gleichzeitig kann jedoch eine bestimmte Modifikation von tRNA [Anmerk. d. Red.: Transfer-RNA, welche während der Translation die richtige Aminosäure zum Ribosom transportiert, passend zu den Codons auf der mRNA], die sogenannte mcm5s2U ( 5-Methoxycarbonylmethyl-2-thiouridin), diesen Effekt ausgleichen. Eine völlig neu entdeckte Ebene der posttranskriptionellen Genregulation, denn man weiß nun sicher: Nicht nur mRNA-, sondern auch tRNA-Modifikationen sind wichtig und beeinflussen gemeinsam mit mRNA die Stabilität der Transkripte.1)
„Dieser Mechanismus wird genutzt, um den Bedarf an Genaktivität unterschiedlich zu regulieren: Haushaltsgene müssen stabilere mRNAs haben als die Gene von Signaltransduktionswegen“, erklärt Linder. „Eigentlich – denn dieser Mechanismus ist bei Krankheiten häufig verändert. Beispielsweise nutzen Krebszellen in hohem Maße die Überaktivierung solcher Signalwege und stabilisieren deshalb die mRNA von Signalmolekülgenen durch modifizierte tRNA, wodurch eine stärkere und länger anhaltende Expression ermöglicht wird. Damit fördern sie Zellwachstum und -aktivität. mcm5s2U und m6A kontrollieren also gemeinsam die Expression von diesen entgleisten Signalwegen.“
Entartete Zellen wieder ins Lot bringen
Die Erkenntnis, dass bestimmte RNA-Modifikationen – also quasi die Umlaute des genetischen Alphabets – gerade in krankhaften Zuständen eine Schlüsselrolle spielen können, brachte den Experten auf die Idee, in dieses System einzugreifen, um die Signalwege wieder in gesunde Bahnen lenken zu können. Und gemeinsam mit dem Biochemiker und Investmentbanker Dr. Karsten Fischer gründete er hierfür 2024 ein Biotechnologie-Start-up mit Sitz in den BioLabs Heidelberg. Für die EMBL-Ausgründung wählten sie einen Firmennamen, der im Gedächtnis bleibt: Umlaut.bio. Bereits kurze Zeit später wurde die Führungsriege aus Chief Executive Officer (CEO) Fischer und Chief Scientific Officer (CSO) Linder um den Medizinalchemiker Dr. Simon Breitler als Chief Development Officer (CDO) ergänzt.
Umlaut.bio nutzt Linders Erkenntnisse aus der RNA-Forschung und entwickelt neuartige Therapeutika, die gezielt die chemischen Modifikationen von tRNA ansteuern, blockieren und damit deren Fähigkeit, mRNA zu stabilisieren, hemmen. Dies soll das unkontrollierte Wachstum von Krebszellen oder auch eine übermäßige Aktivierung bei Entzündungen und Autoimmunerkrankungen stoppen. „Durch die Kontrolle der Genexpression bringen wir die Zellen dazu, ihr bisheriges Programm über den Haufen zu werfen. Die Biologie, die dahintersteckt, ist neu und unglaublich spannend. Diese Wirkstoffklasse hatte so noch niemand vorher auf dem Schirm“, so der Wissenschaftler.
Ansatz kombiniert Präzision mit breitem Wirkungsspektrum
Gestartet sind die Experten wie in der klassischen Wirkstoffentwicklung mit Small Molecules, die die Aktivität der RNA-modifizierenden Enzyme als Targets haben. Als Small Molecules bezeichnet man chemische Verbindungen mit relativ kleiner Molekülmasse, die als Arzneimittel verwendet werden, wie beispielsweise Aspirin oder Ibuprofen. Man habe bewusst so begonnen, um das Risiko zu minimieren, wie Linder sagt. Den Proof of Concept wolle man nun in der Onkologie erbringen. Wenn alles so funktioniert wie man sich dies vorstellt, wäre dies ein grundlegend neuartiges und schonendes Therapiekonzept. Die Krebserkrankungen, die nun zuerst betrachtet werden, sind nicht auf nur eine Indikation beschränkt, denn mit dem Angriff an den tRNA-Modifikationen zielt man generell auf eine gestörte Genregulation ab. An der Translation ändert sich nichts, in dieser Hinsicht kann die tRNA weiterhin ihre Aufgabe erfüllen. „Es gibt durchaus schon Hinweise darauf, mit dieser Strategie Krebszellen inhibieren zu können“, sagt der Gründer.
Den Hochdurchsatzscreen der Small Molecules hat das Start-up vor wenigen Wochen beendet. „Gemeinsam mit einem Partner haben wir das System von Grund auf neu entwickelt und den Screen etabliert. Diese Aufgabe war äußerst schwer“, berichtet Linder. Für den Einsatz im Menschen hat man zwar noch einen langen Weg vor sich, aber das Ziel einer systemischen Anwendung – im Idealfall oral – bereits im Blick: „Unsere Medikamente werden nicht zu vergleichen sein mit gängigen Chemotherapeutika, die zwar vielseitig einsetzbar sind, aber auch viele Nebenwirkungen haben“, erklärt der Molekularbiologe. „Sie ähneln eher präzisionsmedizinischen Ansätzen, die sich an Tumore richten, die ganz spezifische Abhängigkeiten haben. Auch diese gehen auf ganz bestimmte Signalwege zurück. Wir kombinieren dies und treten mit unserer Therapie 'auf die Bremse', um den normalen, natürlichen Signalweg wieder herzustellen. Dies ist für sehr viele Krebstypen erfolgversprechend, und man wird die Qual der Wahl haben, womit man beginnt.“
Sobald dieser Weg einmal beschritten sein wird, möchte das Umlaut-Team auch noch ein zweites Programm angehen: Ansätze für andere tRNA-Modifikationen und weitere Indikationen entwickeln, beispielsweise aus der Immunologie. Zunächst einmal stehen aber ganz aktuell eine neue Investitionsrunde und Fundraising an. „Wir geben alles dafür, dass die Therapeutika so schnell wie möglich zur Verfügung stehen“, so Linder.