Arzneimittel für neuartige Therapien: Gen- und Zelltherapeutika
Mit den neuartigen Gen- und Zelltherapien sind hohe Erwartungen bei der Behandlung unheilbarer und erblich bedingter Krankheiten verbunden. Die Erfolge sind bisher jedoch begrenzt – abgesehen von den seit langem etablierten Knochenmarkstransplantationen mit blutbildenden Stammzellen zur Behandlung von Blutkrebs. Doch haben sich zuletzt die CAR-T-Zelltherapien zu einem großen Hoffnungsträger in der Krebsbehandlung entwickelt.
Bei einer Gentherapie geht es um die Prävention oder Behandlung einer durch ein defektes Gen verursachten Krankheit, indem man das Gen durch Transfer entsprechender Nukleinsäuren in die betroffenen Zellen repariert oder durch ein funktionsfähiges Gen ersetzt. Da Eingriffe in die Gene der Keimzellen oder der frühen Embryonalzellen, die sogenannte Keimbahn-Gentherapie, in Deutschland aus ethischen Gründen verboten sind, wird im Folgenden nur die somatische Gentherapie behandelt, bei der die therapeutische Nukleinsäure in Körperzellen transferiert wird. Die Genveränderung bleibt dabei auf den Empfänger beschränkt und wird nicht an die Nachkommen weitervererbt.
Bei Zelltherapien werden definierte Zellen, die zuvor isoliert und in Zellkultur vermehrt worden sind, in das erkrankte Zielorgan der Patientinnen oder Patienten transplantiert, um dessen Funktionen zu übernehmen und wiederherzustellen. Nach der Herkunft der transplantierten Zellen unterscheidet man:
(i) Autologe Transplantationen, bei denen die Zellen von den Erkrankten selbst stammen, sodass man keine Abstoßungsreaktionen durch das Immunsystem befürchten muss. Allerdings sind die Mengen verfügbarer Zellen für den klinischen Einsatz oft zu gering.
(ii) Meistens wird daher eine allogene Transplantation mit Zellen eines Fremdspenders durchgeführt. Dabei greift man nach Möglichkeit auf immunologisch ähnliche Fremdspender, zum Beispiel enge Blutsverwandte, zurück, um die Gefahr einer Transplantatabstoßung durch das Immunsystem der Patientinnen und Patienten zu reduzieren. Dennoch ist meistens eine immunsuppressive Behandlung erforderlich. Auch bei der Übertragung von Zelllinien aus Zellkulturen besteht die Gefahr der Abstoßung, der man durch die Suppression des Immunsystems begegnen muss.
(iii) Das trifft natürlich auch auf die xenogene Transplantation, die Übertragung tierischer Zellen auf den Menschen, zu.
Bei der Übertragung größerer Zellverbände, wie sie beispielsweise bei Hauttransplantationen im Falle von Verbrennungen notwendig ist, unterscheidet man ebenfalls autologe, allogene oder xenogene Gewebstherapien.
Stammzelltherapien
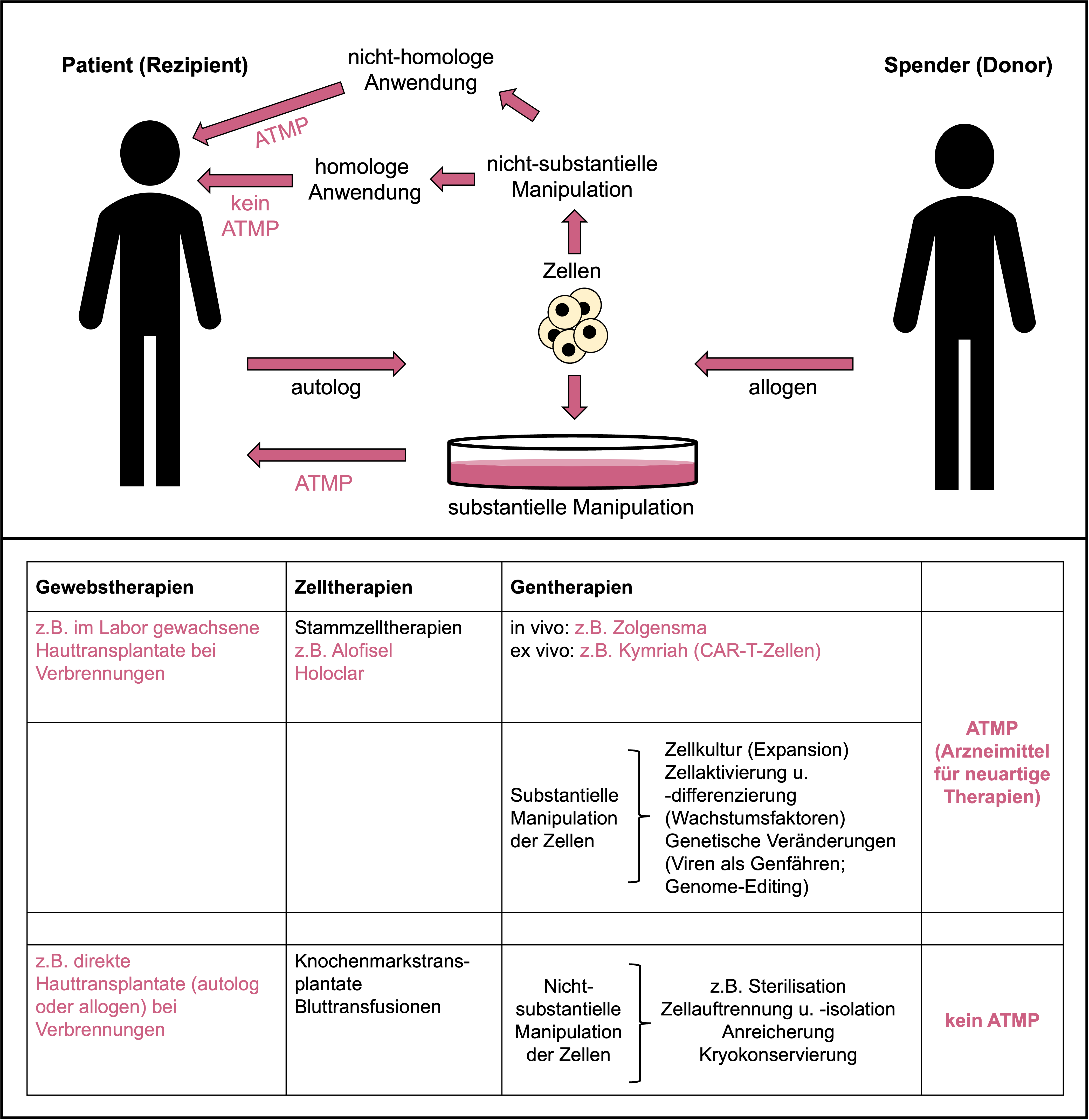 Schema zu den Begriffsbestimmungen von Gewebs-, Zell- und Gentherapien sowie von ATMP. © Dr. Ernst-Dieter Jarasch (in Anlehnung an: Karin Hogedoorn & Heather Main 2020; https://atmpsweden.se, Grafische Umsetzung: Jana Friedl/BIOPRO Baden-Württemberg).
Schema zu den Begriffsbestimmungen von Gewebs-, Zell- und Gentherapien sowie von ATMP. © Dr. Ernst-Dieter Jarasch (in Anlehnung an: Karin Hogedoorn & Heather Main 2020; https://atmpsweden.se, Grafische Umsetzung: Jana Friedl/BIOPRO Baden-Württemberg).Stammzellen sind für den Aufbau und die Reparatur von Organen und Geweben wichtig; sie besitzen daher großes Potenzial, zum Beispiel für die Behandlung degenerativer Krankheiten, die in unseren alternden Gesellschaften immer häufiger auftreten. In besonderem Maße gilt das für humane embryonale Stammzellen (hES-Zellen), die sich zu allen (über 200) verschiedenen Zelltypen unseres Körpers ausdifferenzieren können. Die Gewinnung von hES-Zelllinien aus befruchteten menschlichen Eizellen ist in Deutschland aber durch das Embryonenschutzgesetz verboten. Nur in Ausnahmefällen und für Forschungszwecke ist die Einfuhr von im Ausland hergestellten hES-Zellen zulässig.
Große Hoffnungen setzte man auf die induzierten pluripotenten Stammzellen (iPS-Zellen), die durch Reprogrammierung bereits differenzierter Körperzellen künstlich hergestellt werden. Für ihre Entwicklung hatte der Japaner Shinya Yamanaka 2012 den Nobelpreis erhalten, und Klinische Versuche mit iPS-Zellen werden bis heute vor allem in Japan durchgeführt. Einen ersten Erfolg erzielte man bei einer fast erblindeten Japanerin, der reprogrammierte Stammzellen aus der eigenen Haut ins Auge transplantiert worden waren.
Trotz hunderten von Klinischen Studien gab es bisher mit adulten (somatischen oder gewebespezifischen) Stammzellen nur sehr begrenzte Fortschritte; die Bemühungen zielen vor allem auf die Behandlung von Herzinfarkt, Parkinson-Krankheit, Querschnittslähmung und Diabetes. Die erste von der Europäischen Arzneimittelbehörde EMA zugelassene Stammzelltherapie (Holoclar, für die Regeneration der Hornhaut schwer geschädigter Augen) kam 2015 auf den Markt. Im März 2018 genehmigte die EMA ein weiteres somatisches Zelltherapeutikum (Alofisel), das zur Behandlung von Morbus Crohn, einer schwerwiegenden chronisch entzündlichen Darmerkrankung, dient. Die aktive Substanz von Alofisel besteht aus Stammzellen, die aus dem Fettgewebe von Spenderindividuen isoliert und in vitro vermehrt worden sind.
Diesen spärlichen Erfolgen stehen die mittlerweile etablierten Therapien mit hämatopoetischen (blutbildenden) Stammzellen gegenüber. Sie werden aus dem Knochenmark gewonnen und seit langem an vielen Kliniken zur Behandlung bestimmter Leukämien und Lymphome eingesetzt, so auch beim Multiplen Myelom, einer Krebserkrankung des blutbildenden Knochenmarks.
ATMPs - Advanced Therapy Medicinal Products
Somatische Zelltherapeutika, die für ihren Einsatz im Körper wesentlich manipuliert (substantially manipulated) worden sind – beispielsweise durch ihre Vermehrung in Zellkultur wie bei Holoclar oder Alofisel – werden als ATMPs (Advanced Therapy Medicinal Products) bezeichnet, ins Deutsche übersetzt etwa: „Arzneimittel für neuartige Therapien“. Als nationale Aufsichtsbehörde für ATMPs fungiert das Paul-Ehrlich-Institut (PEI), die europäische Zulassungsstelle ist das Committee for Advanced Therapies (CAT) der EMA. Nach deren Definition umfasst diese Kategorie auch alle Gentherapeutika sowie biotechnologisch bearbeitete Gewebeprodukte (Tissue-engineered Medicines), wie zum Beispiel in Zellkultur gewachsene Hautzellen für die Transplantation bei schweren Verbrennungen.
Normale Hauttransplantate für die Behandlung bei Verbrennungen gelten dagegen nicht als ATMPs. Auch Knochenmarkstransplantationen mit hämatopoetischen Stammzellen sind keine ATMPs, sofern sie nicht substanziell manipuliert worden sind (siehe Schema). Impfstoffe werden ebenfalls nicht den ATMPs zugerechnet, auch nicht rekombinante Virus- oder DNA-/RNA-Vakzine gegen Infektionskrankheiten, wie sie in der Covid-19-Pandemie weite Anwendung erfahren. Ihr Wirkmechanismus ist auf den Krankheitserreger zugeschnitten, und menschliches Erbgut wird dabei nicht verändert. Wenn ein rekombinanter Impfstoff aber für eine wesentlich andere Funktion eingesetzt werden soll als die, für die er ursprünglich entwickelt worden ist (anstatt einer Immunisierung beispielsweise zur Behandlung einer Krebskrankheit), müsste er als ATMP klassifiziert werden.
Gentherapeutika
Das erste in Europa zugelassene Gentherapeutikum war 2012 Glybera zur Behandlung eines familiären (das heißt erblichen) Mangels an Lipoprotein-Lipase (LPL). Wenn das Gen für dieses Enzym ausfällt, kann das Blut der Patientinnen und Patienten mit Fett überschwemmt werden; schwerste Stoffwechselstörungen und Schädigungen von Bauchspeicheldrüse und Leber sind die Folge. Glybera benutzt ein verändertes Adeno-assoziiertes Virus als Vektor oder Genfähre, um ein intaktes LPL-Gen in den Körper der Erkrankten zu schleusen. Der Jubel, dass mit der Zulassung von Glybera der Durchbruch in einer Zukunftstechnologie der Medizin gelungen sei, verhallte jedoch rasch. Die Behandlung mit Glybera zeigte nur begrenzte Wirksamkeit, und sie war sehr teuer. Zudem ist erbliche LPL-Defizienz äußerst selten – nur etwa 1 von 1 Mio. Personen in Europa sind davon betroffen. Am Ende gab es außerhalb der Klinischen Studie nur eine einzige zahlende Patientin in Deutschland; die Behandlung kostete fast 1 Mio. Euro. 2017 wurde Glybera wieder vom Markt genommen.
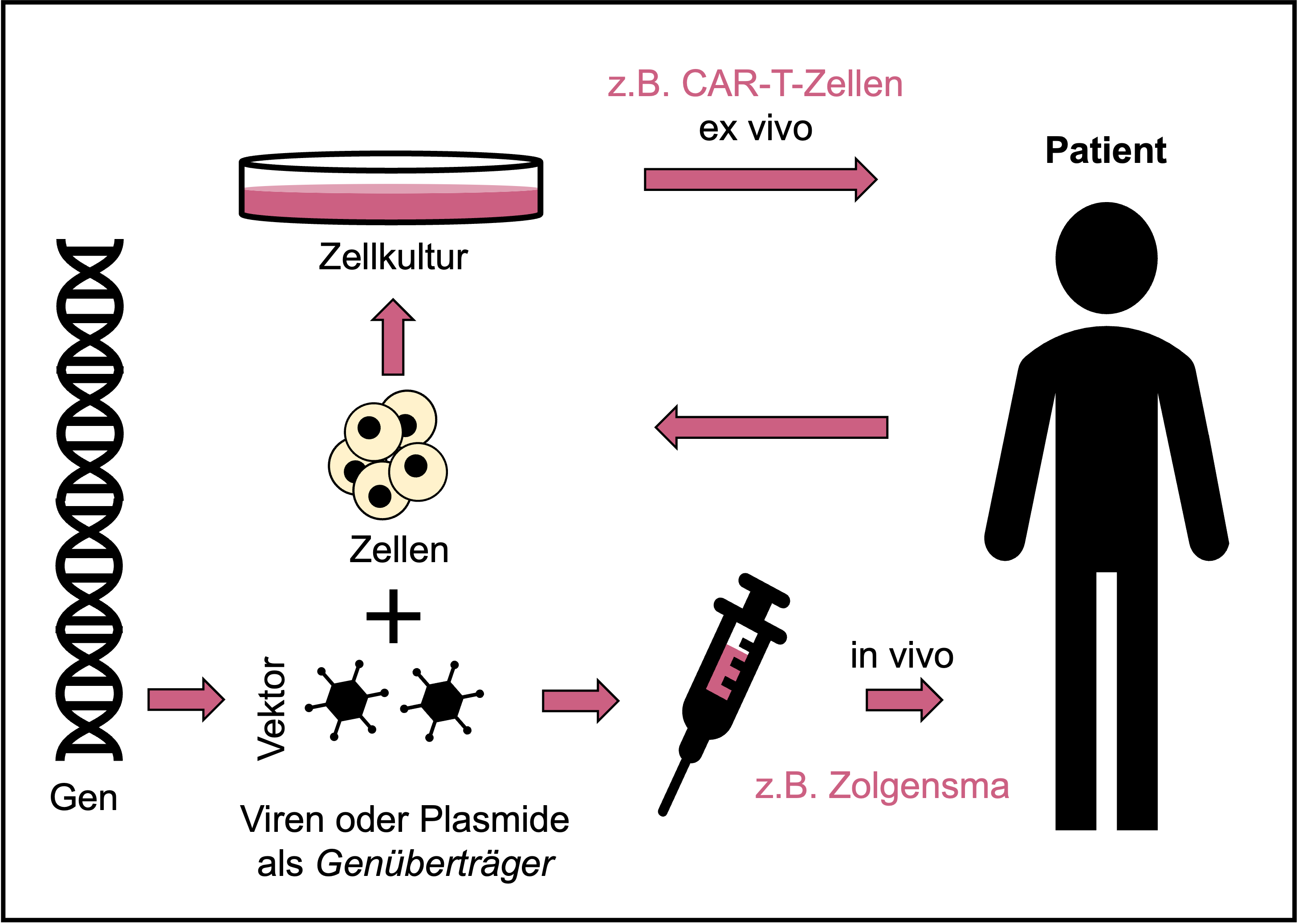 In-vivo- und Ex-vivo-Gentherapeutika am Beispiel von Zolgensma bzw. CAR-T-Zellen. © Dr. Ernst-Dieter Jarasch (Schema in Anlehnung an: Karin Hogedoorn & Heather Main 2020; https://atmpsweden.se; Grafische Umsetzung: Jana Friedl/BIOPRO Baden-Württemberg)
In-vivo- und Ex-vivo-Gentherapeutika am Beispiel von Zolgensma bzw. CAR-T-Zellen. © Dr. Ernst-Dieter Jarasch (Schema in Anlehnung an: Karin Hogedoorn & Heather Main 2020; https://atmpsweden.se; Grafische Umsetzung: Jana Friedl/BIOPRO Baden-Württemberg)Nach Angaben des PEI sind inzwischen zehn weitere Gentherapeutika in Europa zugelassen. Das heißt aber nicht, dass sie auch verfügbar sind. So wurde Skysona nach erfolglosen Kostenverhandlungen mit den Krankenkassen im September 2021 nur drei Monate nach der Zulassung vom US-Hersteller bluebird bio wieder vom Markt genommen. Diese Gentherapie dient der Behandlung einer seltenen Stoffwechselkrankheit bei Kindern, der zerebralen Adrenolekodystrophie, die aufgrund eines Gendefektes zu Schäden im zentralen Nervensystem und meist zu frühem Tod führt. Skysonas Wirksamkeit beruht auf dem Einbau einer funktionstüchtigen Kopie des defekten Gens in die Blutstammzellen mithilfe eines viralen Vektors.
Auch mit Zynteglo, der ersten zugelassenen Gentherapie für Kinder und Jugendliche mit der Erbkrankheit ß-Thalassämie, will sich bluebird bio vom europäischen Markt zurückziehen, weil der pro Behandlung geforderte Preis von fast 1,6 Mio. Euro von den Kassen nicht übernommen wird. Bei Thalassämien kann der rote Blutfarbstoff Hämoglobin nicht richtig gebildet werden, sodass es zu Sauerstoffarmut im Blut und – mit dem Abbau der defekten Erythrozyten – zu einer krankhaften Anreicherung von Eisen kommt. Die Krankenkassen argumentieren nun, dass es schon bisher eine Behandlung gäbe, die zur Heilung von Thalassämie führen könne – nämlich die Knochenmarkstransplantation, eine allogene Transplantation unveränderter Blutstammzellen. Sie kostet nur einen Bruchteil einer Therapie mit Zynteglo, bei der es sich um eine autologe Transplantation von ex vivo (das heißt außerhalb des Körpers) veränderten Blutstammzellen handelt, in die mithilfe eines viralen Vektors eine intakte Variante des defekten Hämoglobingens eingeschleust worden ist.
Prof. Dr. Andreas Kulozik vom Universitätsklinikum Heidelberg, der eine erfolgreiche Klinische Studie mit Zynteglo im Vorfeld der Zulassung durchgeführt hatte, betont aber, dass die Gentherapie nur für eine kleine Gruppe von ß-Thalassämie-Erkrankten mit genau definiertem Krankheitsbild indiziert ist, für die kein geeigneter verwandter Stammzellspender zur Verfügung steht. Rund die Hälfte aller an ß-Thalassämie leidenden Kinder und Jugendlichen können einen solchen passenden Spender nicht finden. Wie bluebird bio mitteilt, sucht das Unternehmen jetzt einen Partner, der die Vermarktung der Gentherapien Zynteglo und Skysona übernimmt. Es besteht also noch Hoffnung, dass sie in Europa erhalten bleiben.
Als Gründe für die exorbitanten Kosten einer Gentherapie werden neben dem hochkomplexen Behandlungsverlauf und der kostspieligen Herstellung der Genfähren das auf jede Patientin und jeden Patienten individuell zugeschnittene Verfahren, geringe Patientenzahlen, aufwändige und lange Studien und hohe Sicherheitsauflagen angeführt. Als teuerstes Medikament aller Zeiten gilt derzeit mit Kosten von über 2,2 Mio. Euro Zolgensma, eine In-vivo-Genersatztherapie gegen spinale Muskelatrophie. Diese Erbkrankheit führt schon bei Kleinkindern wegen Muskelschwund zum Tode oder zu schwersten Behinderungen. Ursache ist ein Gendefekt, der die Motoneuronen im Rückenmark schädigt. Zolgensma, das jetzt vom Schweizer Pharmagiganten Novartis vertrieben wird, ist seit 2020 in Deutschland verfügbar, und allein am Universitätsklinikum Heidelberg wurden bislang 19 Kinder mit dem Arzneimittel behandelt.
CAR-T-Zelltherapie
Novartis hatte im August 2018 auch die europäische Marktzulassung für seine CAR-T-Zelltherapie Kymriah zur Behandlung von bestimmten Blutkrebsarten (akute lymphoblastische B-Zell-Leukämien und B-Zell-Lymphome) erhalten. CAR-T-Zellen sind autologe Immunzellen (T-Lymphozyten), die von Krebspatientinnen und -patienten gewonnen und ex vivo gentechnisch hergestellt werden. Dabei werden sie mit einem künstlichen Rezeptor für ein bestimmtes Krebsantigen verbunden, dem chimären Antigenrezeptor (CAR). Mithilfe dieses Rezeptors können die wieder in die Erkrankten transplantierten CAR-T-Zellen die Krebszellen aufspüren und zerstören. Trotz ihres Namens wird die CAR-T-Zelltherapie meist als Gentherapie klassifiziert, doch mit gleicher Berechtigung kann man sie auch als Immuntherapie bezeichnen. [Bei solchen neuartigen Technologien überschneiden sich oft die Definitionen, und am besten bezeichnet man sie einfach als ATMP.]
Die CAR-T-Zelltherapien haben sich, obwohl sie oft mit schweren Nebenwirkungen verbunden sind, zum heißesten Thema aller Advanced Therapy Medicinal Products entwickelt; es gibt hunderte Klinische Studien bei Krebserkrankungen, die anders nicht mehr zu therapieren waren. Mehrere biopharmazeutische Unternehmen haben für ihre CAR-T-Zelltherapien bereits Zulassungen erhalten – alle bisher für verschiedene hämatologische und lymphatische Krebsformen. In jüngster Zeit gibt es jedoch vielversprechende modifizierte Ansätze, auch solide Tumoren wie Prostata- und Pankreaskarzinome oder Lungenkrebs mit dieser Technologie zu behandeln. Für die Entwicklung der Onkologie und die Krebsbekämpfung sind CAR-T-Zelltherapien einer der großen Hoffnungsträger.